|
|
|
发布时间: 2019-02-10 |
|
|
|
|
收稿日期: 2018-04-18
中图法分类号: TQ034
文献标识码: A
文章编号: 1006-4729(2019)01-0067-05
|
摘要
介绍了TiO2的结构和性质, 以及其催化还原CO2的反应机理。分析了非金属沉积、贵金属沉积、半导体复合和有机光敏剂改性等4类Ti基催化剂光催化还原CO2的性能。
关键词
光催化还原; 金属掺杂; 半导体复合; 有机光敏剂
Abstract
The composition and features of TiO2, as well as its mechanism of photocatalytic reduction of CO2 are introduced.The features of photocatalytic reduction of four kinds of Ti-based catalysts are analyzed, namely, non-metal toping, noble metal settlement; coupled semi-conduct, organic photosensitizer modification.
Key words
photocatalytic reduction; metal toping; semi-conductor reduction; organic photosensitizer
在世界范围内, 越来越多的人关注到能源与环境问题的严重性。由于大气中CO2浓度的增大(从工业化前约280 mL/m3增加到2005年的379 mL/m[1]), 全球气温也随之升高, 发生自然灾害的频率也在增加。因此, 如何减少大气中CO2的浓度, 从根本上控制CO2的排放, 已成为世界共同关注的课题。
控制减少CO2的排放是控制全球变暖的有效措施。目前, CO2减排技术主要有3种:一是CO2收集储存技术, 主要是将CO2封存于地下、海洋, 或将CO2固化成为无机碳酸盐; 二是通过化学方法将CO2转化和利用, 主要是将CO2用于尿素、甲醇以及碳酸饮料的生产; 三是CO2的生物固定, 即利用植物的光合作用将CO2转化为有机物, 进而降低大气中的CO2浓度。
随着人们对CO2减排技术的不断探索和研究, 光催化还原技术得以应用。光催化还原技术具有无毒、耗能低、不会造成二次污染等优点。TiO2能够光催化氧化去除大气中的汞等污染物[2-3], 将CO2催化还原成具有经济价值的有机化合物, 如甲醇、甲烷、甲酸等。与传统的减排技术相比, 利用光催化材料在CO2的治理和利用等方面具有很高的应用价值和前景。
1 TiO2的结构和性质及催化还原CO2的机理
1.1 TiO2的结构和性质
TiO2是一种两性氧化物。目前常见的晶型主要有锐钛矿(anatase)和金红石(rutile)两种。锐钛矿和金红石晶型结构都可以用相互连接的TiO6八面体表示。锐钛矿晶型TiO2是由TiO68-八面体共边构成, 而金红石TiO2的晶型则是由TiO68-八面体共顶点且共边构成。
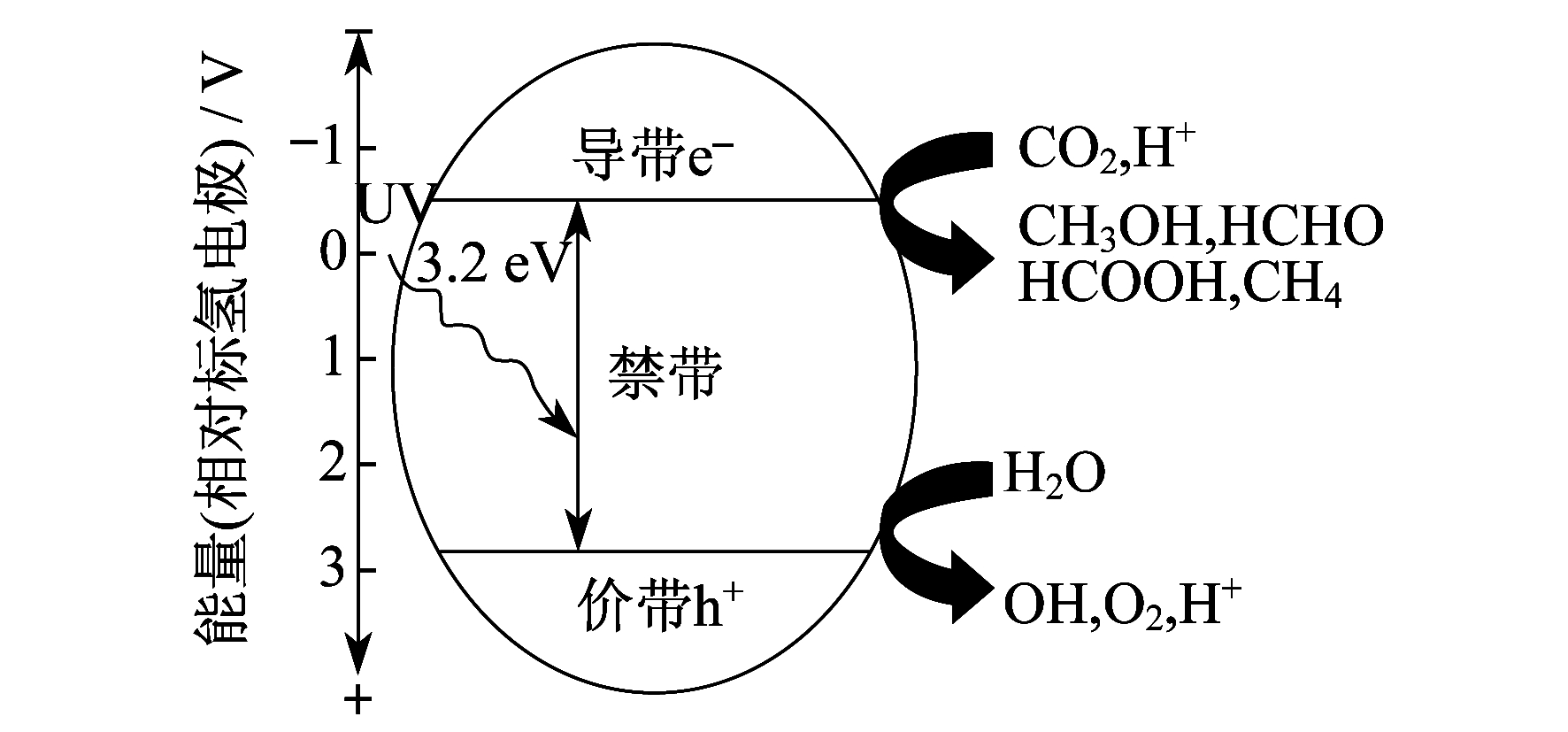
研究表明, 锐钛矿晶型是光催化活性最高的晶型, 其次是金红石晶型。金红石晶型的带隙略低于锐钛矿晶型, 但稳定性比锐钛矿晶型高; 锐钛矿晶型对O2的吸附能力比金红石晶型高。锐钛矿晶型具有较高的光催化活性, 其原因如下:锐钛矿晶型的禁带宽度为3.2 eV, 而金红石晶型的禁带宽度为3.0 eV, 锐钛矿晶型的高禁带宽度使得其电子空穴对具有较高或较低的电位, 因而具有较强的氧化能力; 锐钛矿晶型的表面对H2O, O2, OH-等高活性基团有较强的吸附力, 因而氧化能力比较强; 在结晶过程中, 锐钛矿晶粒一般尺寸较小且比表面积较大, 有利于光催化反应的进行。因此, 两种晶型的TiO2都可能具有较高的活性, 但光的催化活性一般受晶粒的尺寸和比表面积等因素的影响。纳米级TiO2的相关物性见表 1。
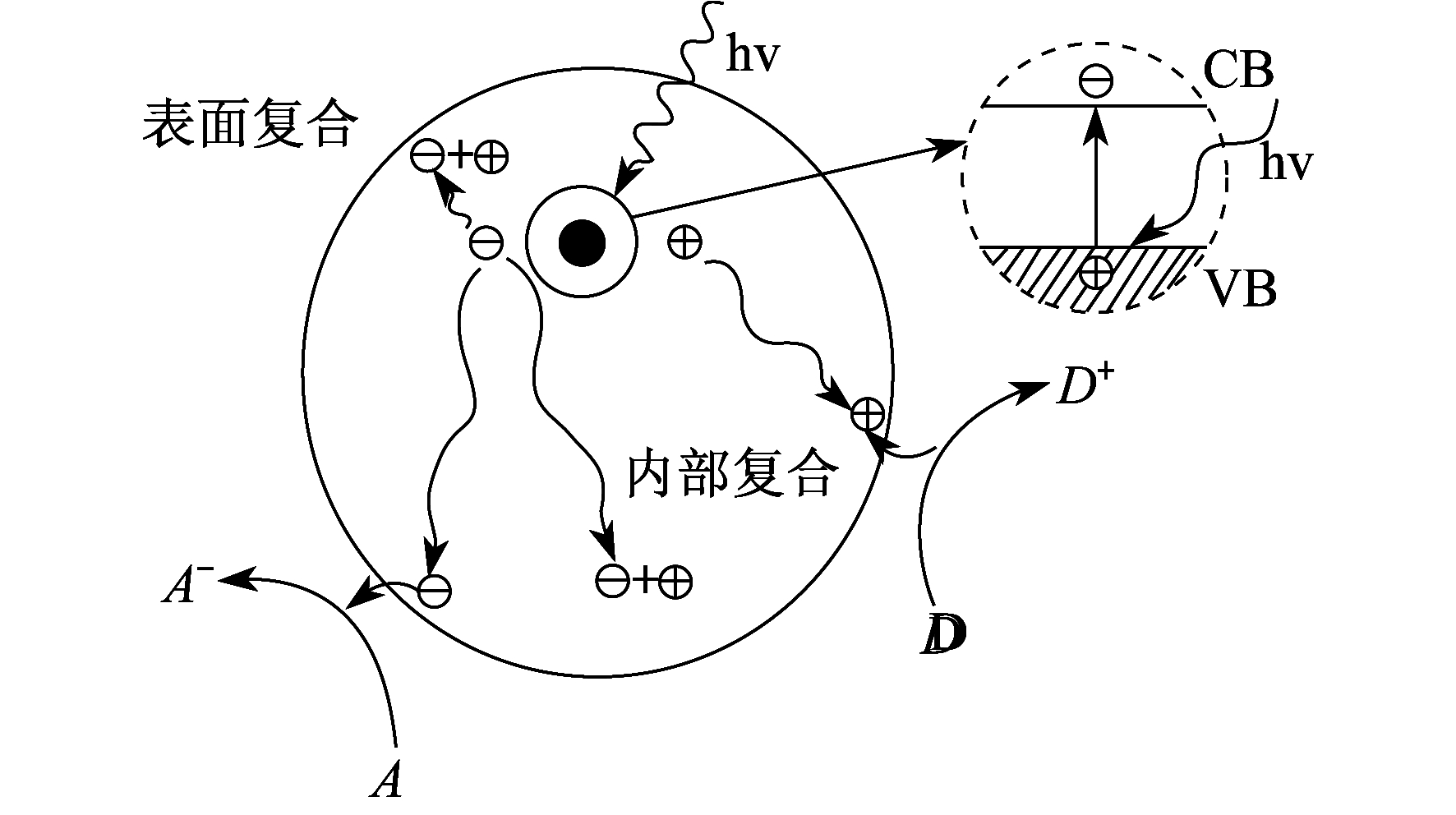
TiO2的特性是在光的照射下, 可以分解出自由移动的带负电的电子和带正电的空穴, 经过许多光化学反应后产生原子氧和自由羟基, 即空穴-电子对, 因此光催化氧化的活性比较强。
表 1
纳米级TiO2相关物性数据
| 晶型 | 性状 | 金红石 含量 | 干燥 减量 | 灼烧 减量 | 重金属 (以Pb计) | 粒径/ nm | 表面 特性 | pH值 | 比表 面积/ (m2/g-1) | 质量分数/% | ||
| % | 砷(As) | 铅(Pb) | 汞(Hg) | |||||||||
| 金红石 | 白色粉末 | 99 | 1 | 10~25 | 0.001 5 | 20~50 | 亲水性或 亲油性 | 6.5~8.5 | 80~200 | 0.000 8 | 0.000 5 | 0.000 1 |
| 锐钛矿 | 白色粉末 | 1 | 10 | 0.001 5 | 15~50 | 亲水性或 亲油性 | 6.5~8.5 | 80~200 | 0.000 8 | 0.000 5 | 0.000 1 | |
1.2 TiO2光催化还原CO2反应机理
TiO2作为一种N型半导体材料, 其能带由3部分构成, 即满电子的价带(Vahence Band, VB)h+、空的高能导带(Conduction Band, CB)e-、导带与价带之间的禁带。禁带的宽度为3.2 eV, 当它被能量大于或者等于能隙的光(387.5 nm的紫外线或近紫外线)照射时, 价带中的电子就会被激发, 形成高活性的带有负电荷的电子e-。带有负电荷的电子跃迁到导带, 与此同时在价带上产生相应的空穴h+, 形成电子-空穴对。因此, TiO2作为催化剂具有一定的氧化、还原能力[4]。
然而, 这些光生电子和空穴都极不稳定, 容易复合且以热量的形式散发。电子和空穴(载体)产生光激发的多路径变化如图 1所示。
TiO2光催化还原CO2的反应具体过程如下:
TiO2+hv→h++e-
H2O+h+→·OH+H+
2H++2e-→H2
CO2+H+ +2e-→ HCO2-
CO2+2H++2e-→ CO+H2O
CO2+4H++4e-→ HCHO+H2O
CO2+6H++6e-→ CH3OH+H2O
CO2+8H++8e-→ CH4+2H2O
该反应过程中的中间产物与自由基发生反应, 生成CH4和CH3OH等有机化合物。TiO2光催化还原CO2示意图如图 2所示。
2 研究现状
目前, 所有半导体材料中TiO2所表现出的光催化反应活性最高, 但TiO2光催化反应的量子效率很低。由于TiO2的带隙高, 所以只有当照射光线的辐射能大于其带隙时, 才能在光催化反应中被利用, 但是太阳光中只有很小的一部分能够满足上述能量需求, 为了提高对可见光的利用和TiO2的活性, 掺杂或者改性TiO2是必然的。
TiO2光催化剂掺杂的方法主要有:非金属掺杂、贵金属沉积、半导体复合, 以及有机光敏剂改性等。
2.1 非金属掺杂
研究发现, 非金属掺杂可以有较高的效率, 并达到对可见光的利用。这些方法包括N掺杂改性、C掺杂改性以及F和S元素等掺杂改性。6种TiO2光催化剂光催化还原CO2的产物及其产率如表 2所示。
表 2
6种TiO2光催化剂光催化还原CO2的产物及其产率
| 光催化剂 | 反应条件 | 产物及其产率 | 参考 文献 |
| TiO2 | 60 W/cm2, UV-light | CH4为3.5 nmol/g, CH3OH为2.4 nmol/g | [5] |
| Cu/TiO2 | 100 mW/cm2, Natural solar light | CxHy, 160 μL/(g ·h) | [6] |
| SiO2/TiO2 | NaHCO3 solution, UV-light 0.3 mW/cm2 | CH3OH, 4.2 mg/(g ·h) | [7] |
| MPc/TiO2 | Alkaline solution, visible light | HCOOH, 450.64 μmol/g | [8] |
| TiO2/Y-zeolite | 55 ℃ | CH4为3~12 μmol/(g·h), CH3OH为1~4 μmol/(g·h) | [9] |
| Fe-TiO2 | 90 ℃, Na2SO3 and NaOH, mixed solution | CH3OH, 308.76 μmol/g | [10] |
对于非金属掺杂TiO2的原理有两种观点:一是认为TiO2晶格氧原子被非金属原子取代而产生了较小的禁带, 从而扩大了对可见光的吸收范围; 二是认为非金属掺杂使TiO2的禁带中出现了一个新的能级, 进而使TiO2具有可见光活性。非金属掺杂TiO2目前已扩展到B, C, S, N, F, Cl, I等元素。这些元素都在氧元素附近, 很容易取代TiO2的晶格氧原子。SILVEYRA R等人[11]用P25与氨水混合制备出的氮掺杂TiO2, 能够提高TiO2的光催化活性。HUSSAIN S T等人[12]合成制备了S掺杂的TiO2催化剂, 发现S掺杂后的TiO2禁带宽度由3.35 eV降到3.25 eV, 催化活性明显增强。研究者认为, 催化剂活性的增强是由于S掺杂进入TiO2的晶格取代了O形成了新的能带。
非金属掺杂能够扩展光反应范围、减少空穴-电子对的复合, 表现为催化效率的提高。但非金属掺杂也存在一些问题:非金属离子掺杂反应机理不明确, 对进一步的研究造成了理论障碍; 非金属掺杂后TiO2的稳定性较差等。
2.2 贵金属沉积
当采用贵金属改性TiO2时, 改变了电子在半导体和金属接触面的分布。通常TiO2的功函数(Φs)低于沉积贵金属的功函数(Φm), 当两个电子转移材料放在一起时, 电子从一个更高的费密能级的n型半导体转移到费密能级低的金属, 直到二者的费密能级相同, 形成空间电荷层。金属表面获得了来自TiO2表面的带负电荷的电子, 在很大程度上提高了光生电子转移到氧的效率。另外, 半导体的能带将在弯曲的表面形成损耗层, 使得金属-TiO2表面形成Schottky能量壁垒, 成为捕捉光生电子的有效陷阱, 抑制了光生电子和空穴的复合, 从而提高了TiO2的光催化效率。
目前应用较多的贵金属主要有Pt, Ag, Au, Pd, Ru, Rh等。RAZZAQ A等人[13]通过特殊的方法制备TiO2光催化剂, 用光分解沉淀法将不同质量比的Pt沉积到TiO2表面, 得到Pt-x-RT, 使产物CH4的产量提高了3倍。LI Y等人[14]利用Cu对TiO2/SiO2进行改性, 改性后的催化剂与改性前相比促进了CH4的生成。因Cu在催化剂表面形成的CuO2抑制了电子与空穴的复合, 从而提高了催化剂的催化效率。
金属对催化剂进行改性时, 掺杂量也具有一个最佳值; 若超过这个最佳值, 则会阻碍光催化反应的进行。ZHANG Q H等人[15]利用水热法合成TiO2纳米管, 并使金属Pt沉积在表面。试验结果表明, 当Pt的改性量为0.15%(质量分数)时, 改性后的催化剂能够有效促进CH4的生成。YAMASHITA H等人[16]利用浸渍法将Cu沉积在TiO2表面。试验结果表明, Cu的最佳掺杂量为3%, 当超过这个最佳掺杂量时, 催化剂的催化效率将会降低。
研究表明, 利用金属对催化剂进行掺杂能够提高催化剂的光催化效率, 主要是由于沉积在表面的金属与TiO2形成Schottky能量壁垒, 有效避免了空穴与电子的复合。金属的种类和改性量也会影响催化效率, 高于或低于掺杂的最佳值都不能达到最佳的催化效果。
2.3 半导体复合
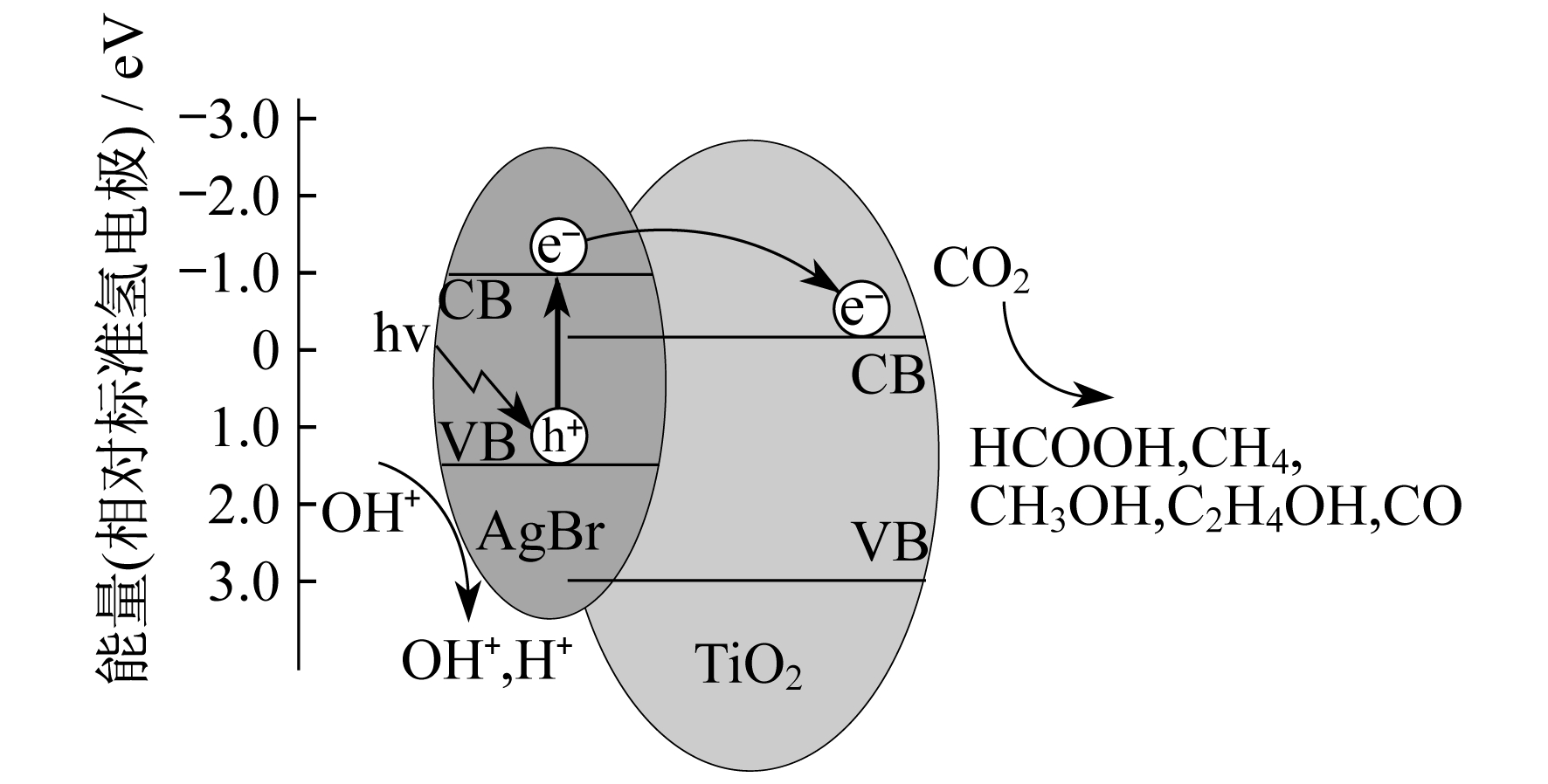
TiO2属于禁带宽度大、导带位置低的半导体, 如果将其与另外一种禁带宽度小、能带位置高的半导体材料复合, 产生的光生电子能够迅速注入较低能级的导带, 有利于光生电子和空穴的转移, 延迟光生空穴的寿命周期, 扩展TiO2光谱响应范围, 可以达到可见光区, 从而提高其光催化活性。上述反应机理如图 3所示。能级的匹配是半导体复合的关键, 近年来有许多关于TiO2/CdS, TiO2/SiO2, TiO2/SnO2等的报道。
QIN S等人[17]制备出半导体复合材料CuO-TiO2催化剂, 并研究了其光催化还原CO2的性能。该催化剂催化还原CO2的还原产物为甲酸甲酯, 半导体的耦合增强了催化剂对可见光的吸收范围。CuO的最佳质量分数约为1.0%, 当质量分数大于1.0%时, 催化剂效率有所下降, 主要是由于过量的CuO聚集在TiO2表面, 影响了光催化剂的光催化性能。
NGUYEN T V等人[18]制备了TiO2/SiO2催化剂、Cu和Fe共掺杂的TiO2催化剂、Cu和Fe共掺杂的TiO2/SiO2催化剂, 并将催化剂负载在光纤上, 研究了Fe和Cu掺杂与SiO2复合对催化剂性能的影响。研究结果表明, 采用SiO2对Cu-Fe/TiO2催化剂进行复合后, 甲烷的生成量有所增加, 催化剂总能量效率由0.015 9%提高至0.018 2%。
王云[19]制备了CeO2/TiO2催化剂, 并研究其光催化还原CO2的性能, 在惰性气氛下处理CeO2/TiO2样品, 表面的Ce3+含量最高, 达62.2%, 其光催化还原CO2产物CH4的量是TiO2样品的4倍。
半导体复合TiO2能够有效分离催化剂的光生电子-空穴对, 进而增强催化剂的光催化活性。虽然耦合合适的半导体能够增强催化剂的催化活性, 但其催化效率相对较低。因此, 复合半导体与其他增强催化活性的方法相结合将成为今后发展的方向。
2.4 有机光敏剂改性
有机光敏剂能有效降低光催化反应所需的能量, 通过化学或物理方法将光敏剂吸附固定在催化剂的表面。因所使用的光敏剂的激发态电势需要比TiO2的导带电势更负, 则激发的电子可以注入到TiO2的导带上; 催化剂利用注入到导带的电子进行CO2的还原, 所以通过光敏剂可以拓宽TiO2的光响应范围, 使太阳光能够得到充分利用, 从而提高TiO2的光催化效率。
目前使用较多的光敏剂主要有酞菁、荧光素、有机染料及生物酶。WOOLERTON T W等人[20]运用生物酶CODH和有机物RuP对TiO2催化剂的表面进行改性, 在MES溶液中进行光催化还原CO2。RuP受到光照, 激发电子经过TiO2的导带传输到生物酶上进行CO2的还原反应。催化还原CO2反应中, 生物酶拓宽了催化剂的光响应范围, 提高了催化效率。因此, 有机光敏剂对TiO2的改性具有重要的意义。
3 结语
TiO2光催化还原CO2技术在CO2减排与资源利用方面具有广阔的前景, 但也存在一些问题, 主要表现在不能有效利用太阳能(光响应范围较低)、光生空穴-电子对容易复合、催化剂对CO2的吸附性能差以及CO2活化等方面。在今后的研究中, 可以将两种或多种方法结合对TiO2进行改性, 将催化剂的研究与结构化学相结合。
随着环境污染问题越来越严峻, 人们将把更多的注意力转移至环境的控制与保护。TiO2作为光催化还原CO2的主要催化剂必然会受到更多的关注。催化剂的发展将会向光响应范围更大、光生载流子活性更高、催化剂活性更强的方向发展。
参考文献
-
[1]CO2温室气体减排现状及对策[J]. 上海电力学院学报, 2010, 26(3): 237-241.
-
[2]TiO2光催化降解气态有机污染物[J]. 上海电力学院学报, 2010, 26(6): 572-576.
-
[3]铈碳共掺杂TiO2脱除烟气汞的实验研究[J]. 上海电力学院学报, 2016, 32(2): 135-139.
-
[4]JI Y, LUO Y. New mechanism for photocatalytic reduction of CO2 on the anatase TiO2(101)surface: the essential role of oxygen vacancy[J]. Journal of the American Chemical Society, 2016, 138(49): 15896. DOI:10.1021/jacs.6b05695
-
[5]YAMASHITA H, KAMADA N, HE H, et al. Reduction of CO2 with H2O on TiO2(100)and TiO2(110)single crystals under UV-irradiation[J]. Chemistry Letters, 1994(5): 855-858.
-
[6]VARGHESE O, AHIABU I, KATUWAL G, et al. Solar photocatalytic conversion of CO2 to fuels by nanostructured oxides[C]//APS March Meeting 2015. American Physical Society, 2015: 265.
-
[7]CO2在纳米SiO2/TiO2悬浮体系中的光催化还原[J]. 化学学报, 2006, 64(6): 453-457. DOI:10.3321/j.issn:0567-7351.2006.06.001
-
[8]Cu/MoO3-TiO2光催化CO2与C3H6反应合成甲基丙烯酸的性能[J]. 催化学报, 2004, 25(12): 937-942. DOI:10.3321/j.issn:0253-9837.2004.12.004
-
[9]温和条件下CoPc/TiO2光催化还原CO2[J]. 精细化工, 2006, 23(1): 54-57. DOI:10.3321/j.issn:1003-5214.2006.01.014
-
[10]YAMASHITA H, FUJII Y, ICHIHASHI Y, et al. Selective formation of CH3OH in the photocatalytic reduction of CO2 with H2O on titanium oxides highly dispersed within zeolites and mesoporous molecular sieves[J]. Catalysis Today, 1998, 45(1): 221-227.
-
[11]SILVEYRA R, SAENZ L D T, FLORES W A, et al. Doping of TiO2 with nitrogen to modify the interval of photocatalytic activation towards visible radiation[J]. Catal Today, 2005, 107: 602-605.
-
[12]HUSSAIN S T, KHAN K. Size control synthesis of sulfur doped titanium dioxide(antase)nanoparticles, its optical property and its photo catalytic reactivity for CO2+H2O conversion and phend degradation[J]. Journal of Energy Chemistry, 2009, 18(4): 383-391.
-
[13]RAZZAQ A, SUBGANAGAOATRA A, KANG T H, et al. Efficient solar light photoreduction of CO2 to hydrocarbon fuels via magnesiothermally reduced TiO2 photocatalyst[J]. Applied Catalysis B Environmental, 2017, 215: 28-35. DOI:10.1016/j.apcatb.2017.05.028
-
[14]LI Y, WANG W N, ZHAN Z L, et al. Photocatalytic reduction of CO2 with H2O on mesoporous silica supported Cu/TiO2 catalysts[J]. Appl Catal B, 2010, 100: 386-392. DOI:10.1016/j.apcatb.2010.08.015
-
[15]ZHANG Q H, HAN W D, HONG Y J, et al. Photocatalytic reduction of CO2 with H2O on Pt-loaded TiO2 catalyst[J]. Catalysis Today, 2009, 148(3): 335-340.
-
[16]YAMASHITA H, NISHIGUCHI H, KAMADA N, et al. Photocatalytic reduction of CO2 with H2O on TiO2 and Cu/TiO2 catalysts[J]. Research on Chemical Intermediates, 1994, 20(8): 815-823. DOI:10.1163/156856794X00568
-
[17]QIN S, XIN F, LIU Y, et al. Photocatalytic reduction of CO2 in methanol to methyl formate over CuO-TiO2 composite catalysts[J]. J Colloid Interface Sci, 2011, 356(1): 257-261. DOI:10.1016/j.jcis.2010.12.034
-
[18]NGUYEN T V, WU J C S. Photoreduction of CO2, to fuels under sunlight using optical-fiber reactor[J]. Solar Energy Materials & Solar Cells, 2008, 92(8): 864-872.
-
[19]王云. CeO2/TiO2的制备及其光催化还原CO2的研究[D].北京: 中国科学院大学, 2016.
-
[20]WOOLERTON T W, SHEARD S, REISNER E, et al. Efficient and clean photo-reduction of CO2 to CO by enzyme-modified TiO2 nanoparticles using visible light[J]. Journal of the American Chemical Society, 2010, 132(7): 2132. DOI:10.1021/ja910091z