|
|
|
发布时间: 2022-04-25 |
清洁安全发电 |
|
|
|
收稿日期: 2021-05-24
基金项目: 安徽省教育厅自然科学项目(KJ2020A0885)
中图法分类号: X172;X171.5
文献标识码: A
文章编号: 2096-8299(2022)02-0139-05
|
摘要
双酚A是油脂类化学品的重要中间体, 在研发生产过程中, 双酚A容易导致空气和水的污染。因此, 采用MoO3作为降解催化剂, 以过一硫酸氢盐(PMS)为氧化剂, 以硫酸根自由基(SO4-·)为基础, 采取高级氧化技术对双酚A污水进行了实验室降解实验。研究了催化剂含量、氧化剂浓度、温度和pH值对降解反应体制的影响, 以寻找实验室降解双酚A的最佳方案。
关键词
高级氧化技术; 过一硫酸氢盐; 双酚A; 催化剂
Abstract
Bisphenol A is an important intermediate of oleochemicals.In the process of R & D and production process development, bisphenol A tends to cause air and water pollution.This paper uses MoO3 as the degradation catalyst, Peroxymonosulfate(PMS)as the oxidant, and sulfate radical (SO4-·) as the basis, and adopts advanced oxidation technology to conduct laboratory degradation experiments on bisphenol A wastewater.The effects of catalyst content, oxidant concentration, temperature and pH value on the degradation reaction system are studied to find the best solution for the degradation of bisphenol A in the laboratory.
Key words
advanced oxidation technology; peroxymonosulfate; bisphenol A; catalyst
双酚A, 其学名为2, 2 - 双(4 - 羟基苯基)丙烷(BPA)[1], 在化学工业中发挥着重要作用。在研发合成制备过程中, 双酚A不可避免地会对气体和水体造成一定的污染。双酚A在我们的生活中无处不在, 各种矿泉水瓶、医疗器械和食品袋中都有它的踪迹[2]。它虽然方便了人们的日常生活, 但也对生态环境和人体健康产生一定的危害。因此, 对双酚A降解及其污染后修复技术的探究, 已成为环境科学领域的重大课题。由于双酚A具有难降解的特点, 常规的水和废水处理方法难以将其完全去除或矿化, 因此探索有效的去除方法迫在眉睫。传统的双酚A污水处理方法有: 固定细菌生物处理法、活性剂吸附物理法和氧化剂氧化化学法[3]。上述方法存在技术成本高、容易造成二次污染且不可循环等缺点[4], 因此需要一种全新高效的降解方法。以硫酸根自由基(SO4-·)为基础的高级氧化[5-7]是一种新兴技术, 在去除难降解有机污染物方面具有巨大潜力, 具有操作简便、高效节能且可以实现重复利用等优点[8-10]。针对均相催化剂使用时金属离子难分离、易引起二次污染的缺点[11], 本文利用过渡金属氧化物中的变价金属, 以非均相催化剂MoO3活化过一硫酸氢盐(Peroxymonosulfate, PMS)产生SO4-·, 提高实验室双酚A降解速率, 为大规模工业运用提供了可行的处理方法。
1 材料与方法
1.1 反应试剂与材料
双酚A和双氧水(AR)从中国医药集团有限公司购买。钼粉(99.0%)从聊城化工股份有限公司购买。液相测试中使用乙腈(梯度色谱级)和水作为试剂。
1.2 实验方法
1.2.1 MoO3制备
在电子天平上称取5 g质量的钼粉, 用量筒准确称取自制的二次去离子水, 在磁力搅拌条件下反应1 h, 向分散液中逐滴加入H2O2(30%)溶液20 mL, 在1 000 r/min条件下搅拌2 h, 溶液由黑色慢慢变为亮黄色。之后, 将上述溶液转移至50 mL的反应器中, 在200 ℃的条件下加热24 h, 得到白色浑浊液体。最后, 将白色沉淀物在10 000 r/min的条件下多次离心操作, 直至溶液变至中性。将MoO3白色粉末放入80 ℃条件的烘箱中进行干燥制备。
1.2.2 双酚A溶液制备及测试
使用电子天平称取20 mg双酚A, 溶于1L的二次蒸馏水中, 在超声波作用下处理1 h, 制备得到双酚A溶液, 其浓度为20 mg/L; 称取不同质量的MoO3和PMS, 将其放入装有双酚A溶液的试管中, 测试双酚A的降解效果。
1.2.3 分析方法
双酚A的液体浓度由仪器Agilent Technologies 1260 Infinity Ⅱ高效液相色谱仪测定。色谱柱的型号为phenomenex C18反相柱(粒径5 μm, 4.6 mm × 250 mm)。用乙腈∶水溶液=60∶40的体积比测定液体流动性。液体流速的检测范围约为0.8 mL/min。直接荧光波长检测器为发射波长280 nm, 吸收波长314 nm。在此液相条件下, 保留时间4.5 min。
2 结果与讨论
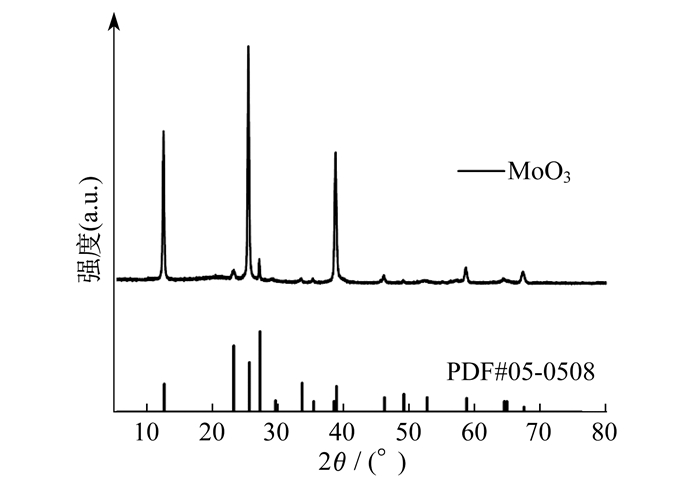
MoO3的X射线衍射(X - ray Diffraction, XRD)图如图 1所示。
通过对比衍射峰与标准卡(PDF#05 - 0508)的位置, 观察衍射峰的强度, 可以看出MoO3的结晶度很好, 没有杂峰的出现, 排除了外在因素对双酚A降解时的影响。
MoO3的扫描电子显微镜(Scanning Electron Microscope, SEM)特征图如2所示。
从图 2可以清晰地看到, 纳米条状与晶粒分布均匀、结构单一。这种形貌的存在, 有利于提高氧化剂与催化剂之间的接触面积, 增加反应的活性位点。由于催化剂表面不存在间隙, 在降解过程中避免了催化剂的堵塞, 有利于提高降解率。
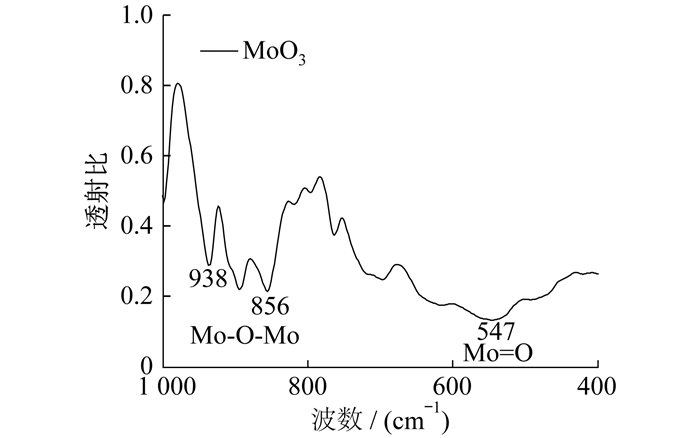
MoO3的红外特征图谱如图 3所示。
从图 3可以看出, 对于MoO3而言, 在938 cm-1和856 cm-1位置检测到Mo - O - Mo单元的伸缩振动, 而在547 cm-1位置为Mo=O的伸缩振动, 进一步证明了合成物质为MoO3, 且成分单一。
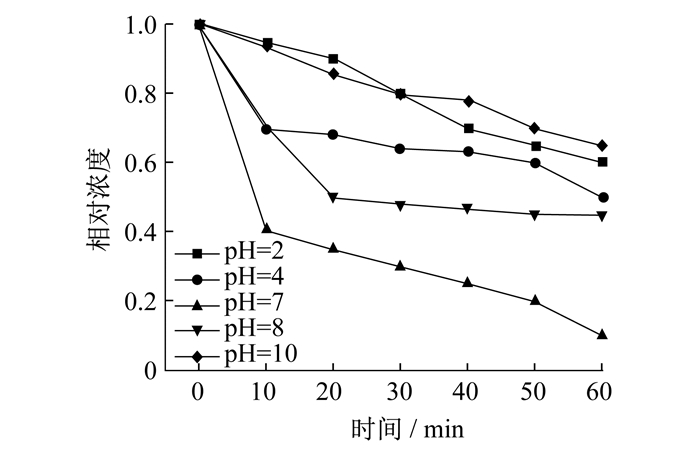
在进行测试双酚A降解效果前, 首先测试pH值对双酚A降解的效果影响。不同pH值对降解双酚A的影响如图 4所示。从图 4可以看出, 在酸性条件下, 大量的氢离子作为自由基清除剂, 影响降解效果。在碱性条件下会产生活化作用, 但碱性太强, 也不利于自由基的存在。中性条件下双酚A的降解效果最好。因此, 降解实验中降解条件皆为中性环境。
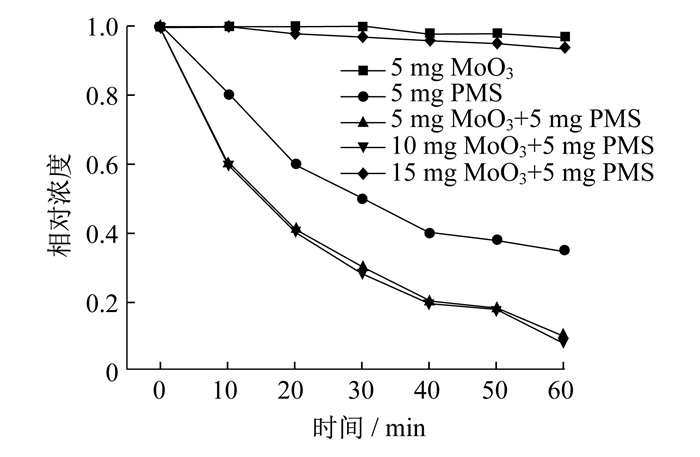
污染源采用双酚A溶液, 浓度为50 mg/L, 使用量筒称取50 mL。称取5 mg PMS作为氧化剂, MoO3催化剂的质量分别为5 mg, 10 mg, 15 mg, 不同催化剂量对降解双酚A的影响如图 5所示。
由图 5可知: 当只有PMS作用时, 在60 min内降解双酚A的效率极差, 只有3%的双酚A被降解。当只有MoO3作用时, 在60 min内降解双酚A的效率极差, 只有6%的双酚A被降解, 反映出MoO3对双酚A吸附效果较差。当添加5 mg MoO3催化剂时, 在60 min的降解时间内, 降解效率达到了65%。添加10 mg MoO3催化剂时, 在60 min的降解时间内, 双酚A的降解效率达到了90%。添加15 mg MoO3时, 降解效率达到了92%。虽然催化剂量能提高降解效率, 但增加到一定量时, 对双酚A的降解效率提高不大。原因是当PMS为一定质量时, SO4-·的生成量是一定的, 即使催化剂质量增加, SO4-·的量也不会增加。
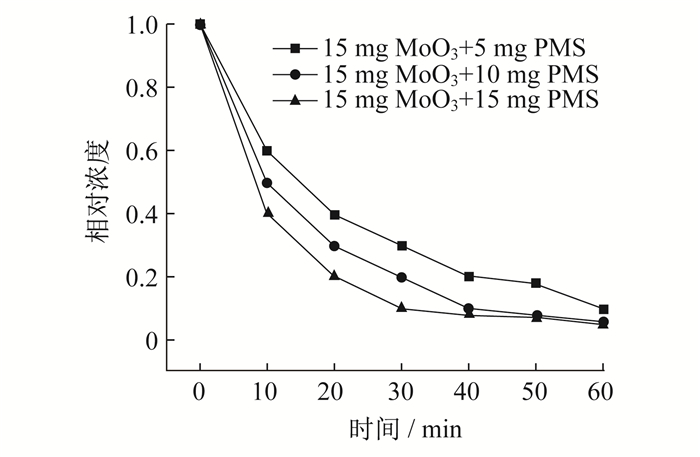
称取15 mg MoO3催化剂, 分别称取5 mg, 10 mg, 15 mg PMS, 研究氧化剂使用量对降解双酚A的影响, 具体如图 6所示。
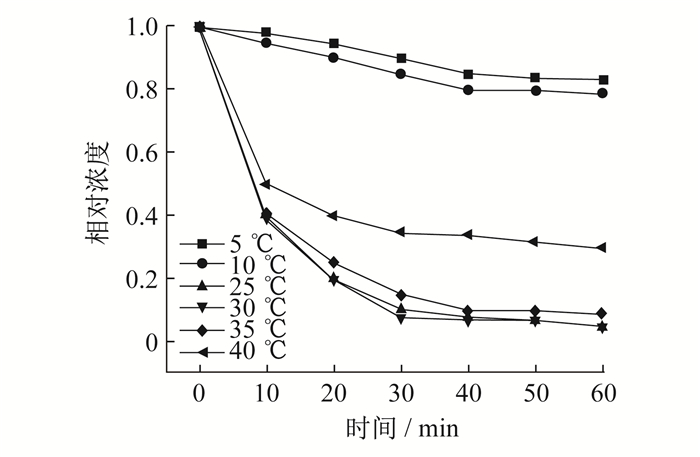
由图 6可知, 当取5 mg PMS时, 在60 min内, 对双酚A的降解效率达到了90%, 当PMS的质量增加到10 mg和15 mg时, 降解效率分别达到94%和95%。由于PMS生成自由基已经达到了一定饱和, 使用再多的催化剂量也无法产生自由基, 因此, 提高幅度不大。由实验可知, 当氧化剂和催化剂的质量比为1∶1时, 降解效果和性价比最好。因此, 下述实验中所使用的催化剂和氧化剂的质量均为15 mg。称取15 mg PMS和MoO3, 在5 ℃, 10 ℃, 25 ℃, 30 ℃, 35 ℃, 40 ℃的条件下对双酚A进行降解测试, 结果如图 7所示。
由图 7可知, 在5 ℃和10 ℃的条件下, 双酚A的降解速度非常缓慢。这是因为PMS生成SO4-·需要一定的能量来促使O O键断裂[12], 温度较低时无法提供断裂所需要的能量。在这种条件下单纯地依靠PMS来降解双酚A效果较差。当温度条件为30 ℃和35 ℃时, 与室温条件相比, 相同时间内降解差异不大, 无论是降解效果还是能量消耗方面, 25 ℃时是最佳的降解条件。当温度过高时, 降解效果反而出现滞后现象, 原因在于温度过高时, 生成自由基的浓度较大[13], 使得自由基间发生一定的反应, 而不会优先选择与污染物发生反应。
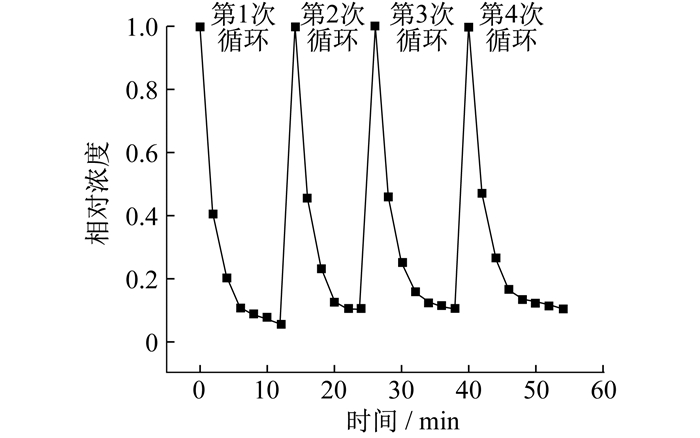
在室温条件下, 测试催化剂的循环性能所使用的PMS和MoO3的质量为15 mg, 降解效果如图 8所示。
从图 8可以看出, 与首次降解相比, 后续循环用的催化剂降解效果稍低, 但相对稳定, 说明选用的催化剂具有好的可逆循环性能, 在降解双酚A方面可以达到循环使用的效果。在金属氧化物表面, MoO3被用作催化剂, 因过渡金属氧化物上存在变价金属离子, 因此电子能转移到PMS的表面, 激活活性氧物种的形成, 进一步促进自由基的形成, 从而实现污染物的高效能降解。在加入TBA猝灭剂进行猝灭实验时, 发现降解效果抑制并不明显, 说明产生了羟基自由基, 但是还是以硫酸根自由基为主。由于实验室中的双酚A废水存在阴阳离子, 阴阳离子的存在可以作为自由基清除剂或者生成催化活性较低的自由基, 从而抑制反应, 使得双酚A的降解率下降。
3 结语
通过研究实验室废水中双酚A的降解, 可以发现, MoO3和PMS的组合具有高效的降解效率。MoO3催化剂具有以下优点: MoO3的纳米片状结构增大了与氧化剂之间的接触面积, 致使活性位点增多, 加速了SO4-·的生成; 过渡金属氧化物可以对PMS进行活化, 加速PMS中O O键的断裂; 催化剂可以直接回收和循环利用, 具有简单、绿色等优点。
由于MoO3催化剂在实验室双酚A废水处理方面具有良好的降解效果, 因此可以考虑将MoO3活化PMS生成SO4-·这一高级氧化技术推广应用于大规模工业废水的处理中, 实现高效便捷的有机污染物的降解。
参考文献
-
[1]徐斌, 高乃云, 芮旻, 等. 饮用水中内分泌干扰物双酚A的臭氧氧化降解研究[J]. 环境科学, 2006, 27(2): 294-299. DOI:10.3321/j.issn:0250-3301.2006.02.019
-
[2]LI J Q, HAO H J, ZHU Z F, et al. Construction of g-C3N4-WO3-BI2WO6 double z-scheme system with enhanced photoelectrochemical performance[J]. Materials Letters, 2016, 168: 180-183. DOI:10.1016/j.matlet.2016.01.058
-
[3]朱斌, 钟理. 高级氧化技术降解水中环境激素的研究进展[J]. 工业水处理, 2008, 28(1): 5-8. DOI:10.3969/j.issn.1005-829X.2008.01.002
-
[4]聂冬, 金明姬, 董微巍, 等. 高级氧化法在水处理领域中得应用研究[J]. 延边大学农学学报, 2014, 36(2): 179-185. DOI:10.3969/j.issn.1004-7999.2014.02.017
-
[5]许涛, 宋国勇. 难降解有机废水的高级氧化技术[J]. 辽宁城乡环境科技, 2005, 25(3): 44-46. DOI:10.3969/j.issn.1674-1021.2005.03.020
-
[6]张峰, 李文奇, 冯传平, 等. 聚丙烯腈纱负载TiO2-SiO2光催化降解苯酚[J]. 化工环保, 2010, 30(6): 530-533. DOI:10.3969/j.issn.1006-1878.2010.06.017
-
[7]李一凡, 王应军, 廖鑫. CuO/Ac催化过硫酸盐对模拟废水中苯酚的降解效果[J]. 环境科学研究, 2018, 31(11): 1949-1956.
-
[8]许若梦, 吴桐, 锁瑞娟, 等. 基于不同自由基的高级氧化技术对水中诺氟沙星的去除效果[J]. 环境工程技术学报, 2020, 10(3): 433-439.
-
[9]赵文莉, 王广智, 弋凡, 等. 过硫酸盐活化技术的研究进展[J]. 现代化工, 2018, 38(7): 53-56.
-
[10]李一凡, 王应军, 廖鑫. CuO/Ac催化过硫酸盐对模拟废水中苯酚的降解效果[J]. 环境科学研究, 2018, 31(11): 1949-1956.
-
[11]李劢, 郭兴芳, 申世峰, 等. 过硫酸盐不同活化方式的研究进展[J]. 天津科技, 2021, 48(1): 38-41.
-
[12]OH W D, DONG Z, LIM T T. Generation of sulfate radical through heterogeneous catalysis for organic contaminants removal: current development, challenges and prospects[J]. Applied Catalysis B: Environmental, 2016, 194: 169-201. DOI:10.1016/j.apcatb.2016.04.003
-
[13]FENG Y, SONG Q, LV W, et al. Degradation of ketoprofen by sulfate radical-based advanced oxidation processes: Kinetics, mechanisms, and effects of natural water matrices[J]. Chemosphere, 2017, 189: 643-651. DOI:10.1016/j.chemosphere.2017.09.109