|
|
|
发布时间: 2020-02-10 |
|
|
|
|
收稿日期: 2019-05-01
基金项目: 国家自然科学基金(21507081)
中图法分类号: TM912
文献标识码: A
文章编号: 1006-4729(2020)01-0071-07
|
摘要
传统合成铁/铝水滑石纳米片(Fe/Al-LDHs)方法往往需要使用不稳定的铁盐, 还要在一定温度下进行长时间的老化。为了克服这些缺点, 开发了一种易于操作、环境友好且可以规模化操作的电化学牺牲阳极水滑石制备方法。采用牺牲阳极法成功地合成了六边形Fe/Al-LDHs, 厚度约为32 nm, 直径为50~100 nm, 金属摩尔比[Fe]/[Al]=2:1。实验表明:Fe/Al-LDHs的结晶过程主要依赖于最先沉淀的Al(OH)3形成的晶核和Fe的化学价; 在低电流密度下, 同时采用Fe和Al为牺牲阳极, 通过控制输出电流来控制阳极电解的金属量, 可快速大规模制备Fe/Al-LDHs, 具有良好的应用前景。
关键词
电化学; 牺牲阳极法; 铁/铝水滑石
Abstract
Conventional methods for the synthesis of Fe/Al-LDHs often require the use of unstable iron salts and prolonged aging at a given temperature.In order to overcome these shortcomings, an electrochemical sacrificial anode hydrotalcite preparation method is developed, which is easy to operate, environmentally friendly and can be operated on a large scale.Hexagonal Fe/Al-LDHs was successfully synthesized by sacrificial anode method, with a thickness of about 32 nm and a diameter of about 50~100 nm, and a metal molar ratio[Fe]/[Al]=2.Experiments show that the crystallization process of Fe/Al-LDHs mainly depends on the crystal nucleus formed by the first precipitation Al(OH)3 and the chemical valence of Fe.Under low current density, Fe and Al are used as sacrificial anode simultaneously, and the amount of metal in anode electrolysis can be controlled by controlling the output current.Fe/Al-LDHs can be prepared rapidly and in large scale, which has a good application prospect.
Key words
electrochemistry; double anode method; Fe/Al-LDHs
水滑石(LDH)是一种层状无机晶体新型材料, 具有独特的双片层结构、热稳定性、层间阴离子可交换和记忆效应等性质, 已经在防腐、催化、吸附和医药等领域得到了广泛应用。近几年, 研究人员在各种LDH以及改性LDH的制备方法上做了大量的研究[1-3]。这些研究针对不同的使用目的, 提出了很多优秀的改进方法, 但都无法避免金属盐和/或有机溶剂的使用, 且制备过程中需要精确控制金属盐的用量、高温或老化步骤。为了克服上述问题, 需要探究一种可避免添加金属盐及高温烧制, 且制备过程快速简单的新型电化学合成方法。电化学牺牲阳极法本质是一种电解池, 在通电的过程中活泼性阳极溶解, 溶解的金属离子在溶液中发生水解聚合反应。前期关于电化学牺牲阳极法的研究主要集中于电絮凝技术对污染物的去除效率及影响因素的探究, 忽略了电解产物本身, 且鲜有采用多个电源同时引入多种元素, 以扩宽材料的种类和应用的研究。本文以Fe和Al为电极, 以硫酸钠为电解质, 采用牺牲阳极法一步制备Fe/Al-LDHs, 以探究该方法在材料制备应用上的可能性。
1 实验部分
1.1 牺牲阳极法制备Fe/Al-LDHs
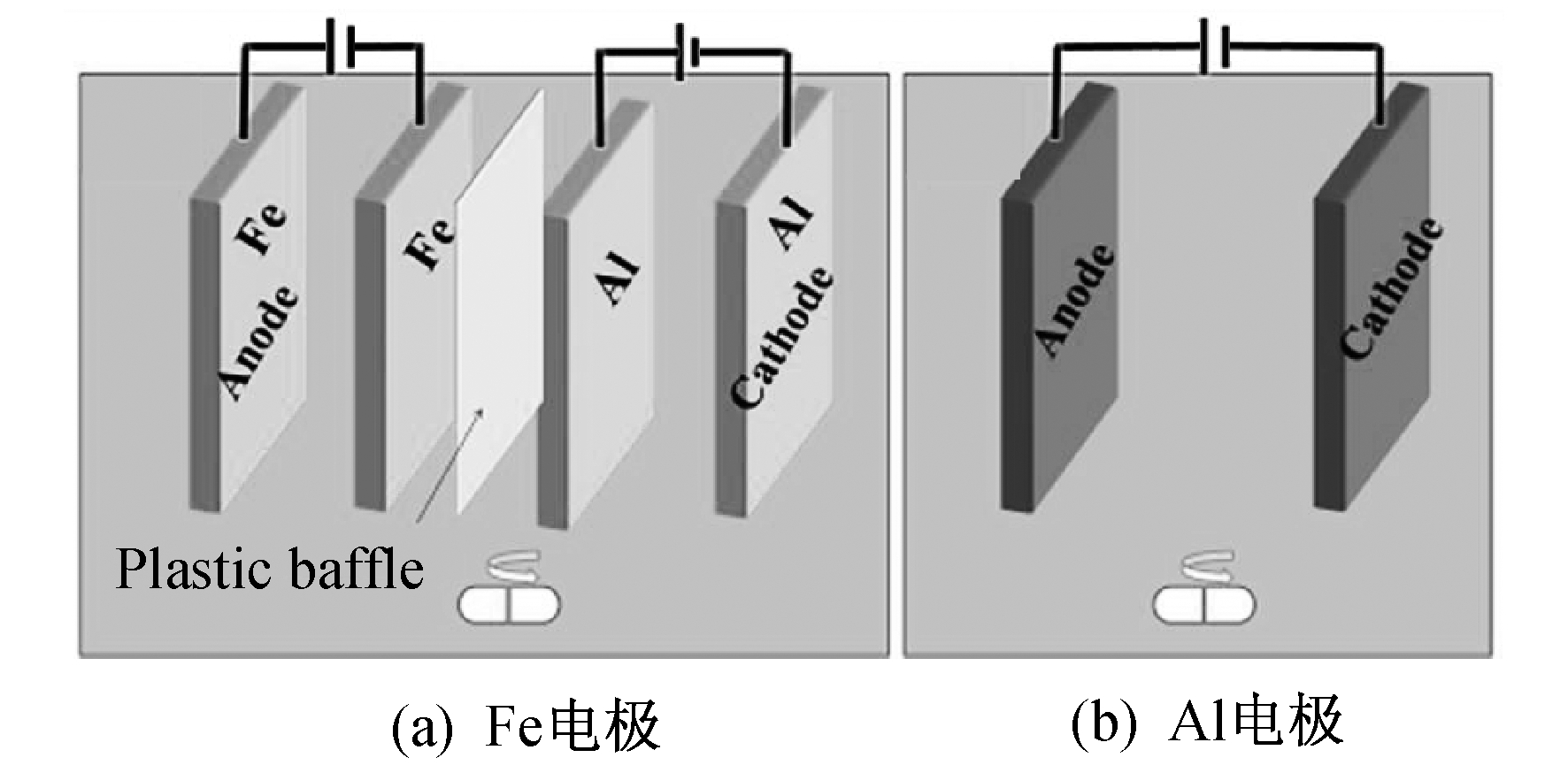
牺牲阳极法制备Fe/Al-LDHs是同时将Fe和Al作为电极, 利用电解过程的阴阳极产物, 自发共沉淀形成目标产物的方法。以Na2SO4(2 g/L)作为电解质, 为了彻底避免溶解氧的影响, 配置好的电解质溶液在电解之前需要通氮气30 min。采用两套直流电源(DC)分别控制Fe电极(通过电流为IDC1)和Al电极(通过电流为IDC2)的电解量, 电极排布方式如图 1所示。仅用Fe作电极时, IDC1为0.20 A; 以Fe(II)/Al(III)为电极时的输入电流IDC2, 如表 1所示。悬浮液经电化学反应后离心脱水, 冷冻干燥3天, 立即保存在厌氧容器中。整个过程必须快速密封, 避免引入氧气。
表 1
以Fe(II)/Al(III)为电极时的输入电流
| $\mathrm{Fe}(\mathrm{II}) / \mathrm{Al}(\mathrm{III})的摩尔比$ | $I_{\mathrm{DC}_{1}} / \mathrm{A}$ | $I_{\mathrm{DC}_{2}} / \mathrm{A}$ |
| 1 | 0.20 | 0.30 |
| 2 | 0.20 | 0.15 |
| 3 | 0.20 | 0.10 |
| 4 | 0.40 | 0.15 |
| 5 | 0.40 | 0.12 |
1.2 控制组LDHs制备方法
Fe/Fe-LDHs-co和Fe/Al-LDHs-co是在前人研究的基础上, 采用共沉淀法制备而成[1-2]。简而言之, 将Na2SO4·10H2O(9.65 mg/L)、FeCl2·4H2O(23.84 mg/L)、FeCl3·6H2O(16.22 mg/L)或AlCl3·6H2O(16.22 mg/L)在100 mL的溶液中剧烈搅拌后, 立即加入NaOH(9.6 mg/L, 100 mL)。采用FeCl3·6H2O或AlCl3·6H2O作为三价金属盐, 合成Fe/Fe-LDHs-co和Fe/Al-LDHs-co。以Fe为电极制备CoFe-LDH, 用Co2SO4代替Na2SO4作为电解液, 保持[Co]/[Fe]的摩尔比为2, 通过电解时间来控制Fe的电解量。
2 牺牲阳极系统性能实验
2.1 牺牲阳极一步合成法概述
2.2 阳极溶解性能探究
在研究电化学法合成Fe/Al-LDHs之前, 首先对金属阳极的溶解性能进行了研究。根据Fe/Al-LDHs的组成,
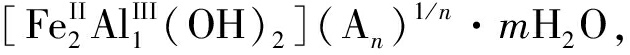 可知[Fe(II)]/[Al(III)]的摩尔比为2。因此, 电化学系统中, 理论上溶解的金属摩尔比[Fe]/[Al]也控制在2。Fe电极作为使用最广泛的电极材料, 其在水溶液中发生的化学反应非常复杂。
可知[Fe(II)]/[Al(III)]的摩尔比为2。因此, 电化学系统中, 理论上溶解的金属摩尔比[Fe]/[Al]也控制在2。Fe电极作为使用最广泛的电极材料, 其在水溶液中发生的化学反应非常复杂。
目前, Fe电极在电化学反应过程的机理还没有完全确定, 因为阳极氧化既可能产生Fe(II), 又可能产生Fe(III)。
| $ \begin{aligned} & \mathrm{Fe} \rightarrow \mathrm{Fe}(\mathrm{II})+2 \mathrm{e}^{-}\end{aligned} $ | (1) |
| $ \begin{aligned} & \mathrm{Fe} \rightarrow \mathrm{Fe}(\mathrm{III})+3 \mathrm{e}^{-} \end{aligned} $ | (2) |
假设Al电极的主要阳极反应为
| $\mathrm{Al} \rightarrow \mathrm{Al}(\mathrm{III})+3 \mathrm{e}^{-}$ | (3) |
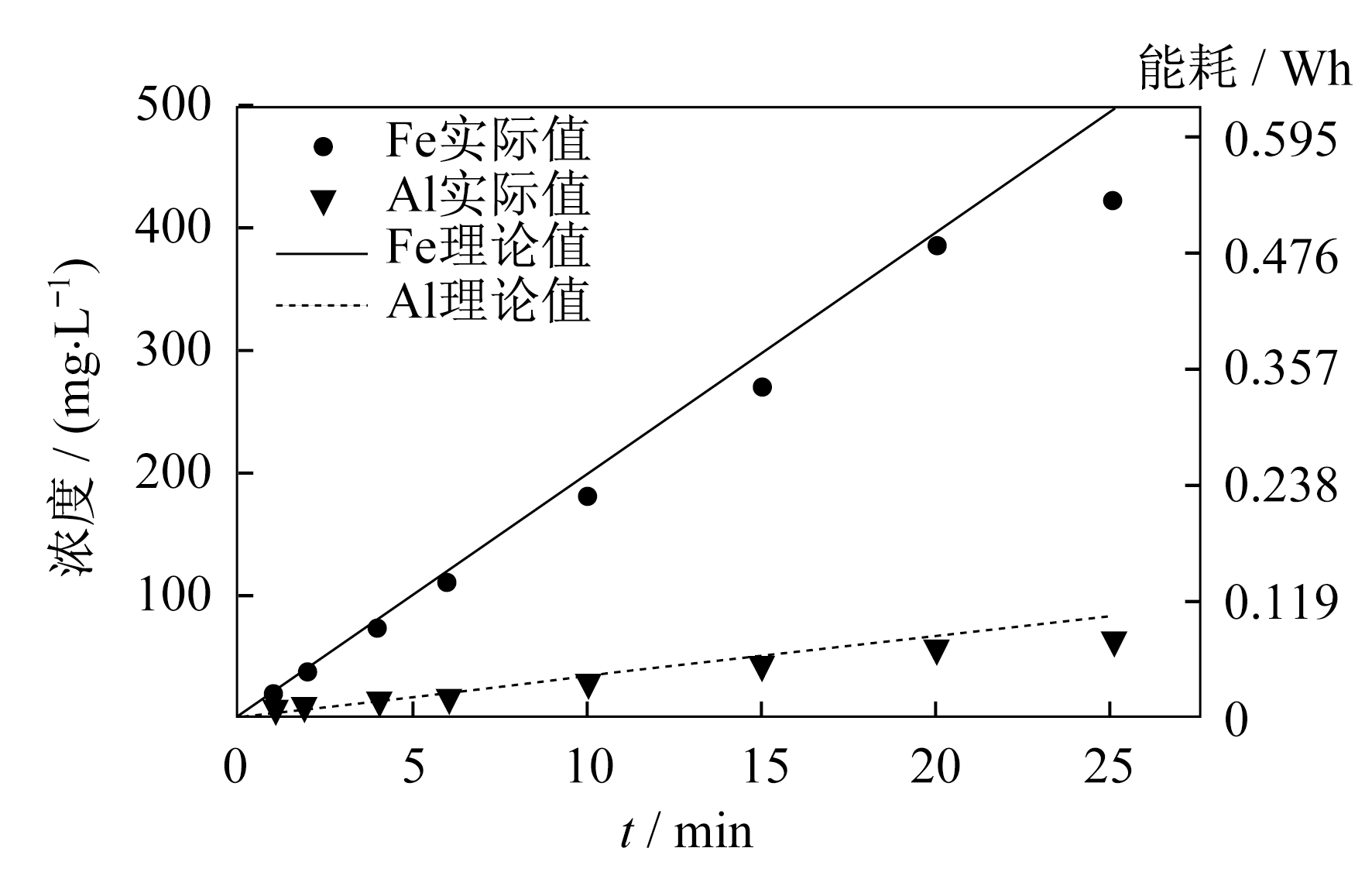
根据法拉第定律, 保持电流不变, 总金属的溶解量会随着电解时间的延长而增加, 金属Fe和Al的理论溶解量可以通过法拉第定律算出。具体如图 2所示。
由图 2可知, 金属的理论溶解量与实际检测值保持一致, 随着电解时间的延长, 可能是因为阳极表面出现了钝化层, 法拉第效率有所降低。Fe电极实际溶解量与理论Fe电极释放的Fe(II)数量相当, 说明Fe阳极发生式(1)的反应[6]。在不通电条件下, 金属在电解质溶液中放置相同时间, 溶液中的金属离子含量几乎为零, 可忽略不计, 说明金属离子来源于电解溶解, 而不是自发溶解。在电流密度i为0.2 mA/cm2条件下, 电解过程中释放0.087 g Fe(II)和0.020 g Al(III), 电化学合成Fe/Al-LDHs的能耗在25 min内小于0.60 Wh, 在工业大规模合成上很有潜力。
3 Fe/Al-LDHs的表征与成核机制
3.1 Fe/Al-LDHs的表征
本文主要从材料的内部原子或分子的结构、材料形貌及成分方面对牺牲阳极法生成的材料进行详细表征, 具体如图 3所示。
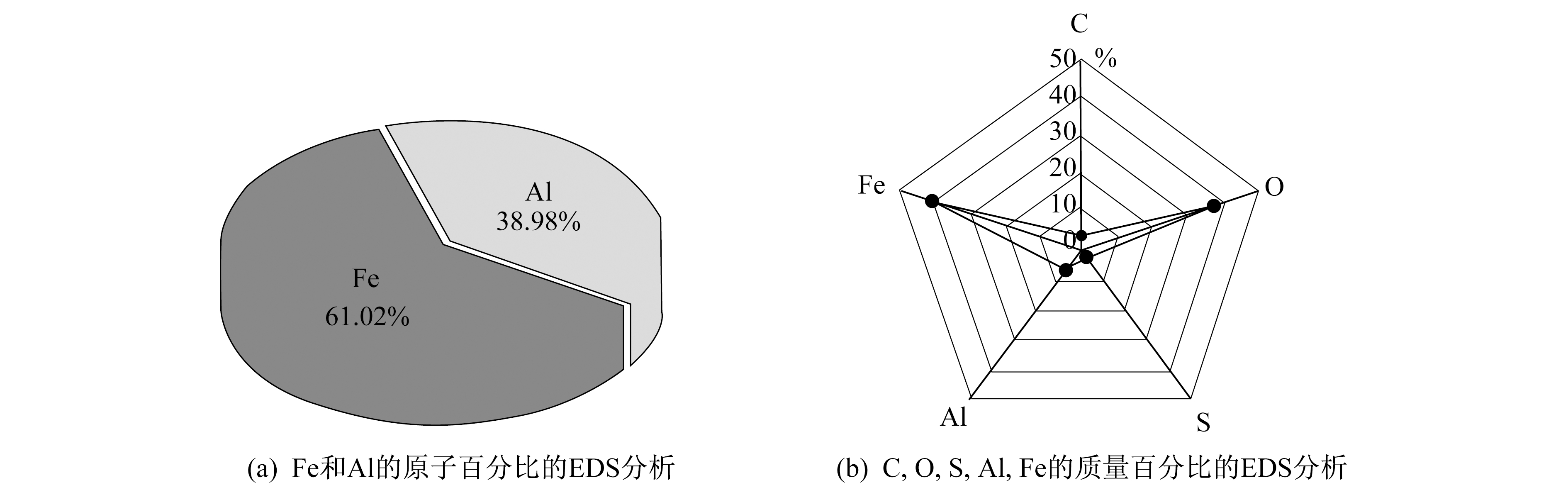
Fe/Al-LDHs中Fe和Al的原子百分比的EDS分析和其中C, O, S, Al, Fe的质量百分比的EDS分析如图 4所示。
由图 3(a)可知, 该材料具有一组水滑石结构特征的X射线衍射(XRD)峰, 可以识别R-3m对称性。由图 3(b)可知, 材料的XRD的峰强度较弱, 而且峰宽较大, 表明该材料的结晶度较低, 结晶域较小。结合选区电子衍射(SAED)的衍射环分析, 说明材料结构是半晶体结构, 结晶性较弱。通过扫描电镜(SEM)进一步观察发现, 其具有良好的分散性, 大小均匀, 呈片状结构。元素图谱显示, Fe和Al元素在LDH纳米片中的分布较为均匀。由图 3(c)可知, TEM再一次证实了材料是六边形纳米片结构, 与LDH的结构吻合[7], 且LDH薄片的横向尺寸在50~100 nm之间。图 3(d)中的原子力显微镜(AFM)图像显示, 多层的Fe/Al-LDHs厚度为32.25 nm。地表面积(BET)数据表明, LDH薄片的比表面积为141.80 m2/g。此外, 由图 3(e)可知, LDH纳米薄片的元素映射显示, Al, Fe, O, S元素在纳米片上均匀分布。
由图 4可知, EDS和ICP测定LDH片中的Fe:Al原子比分别为1.8:1和1.9:1(400.31 mg/gFe:100.62 mg/gAl), 这与水滑石分子结构中二价离子和三价离子的摩尔比[M(II)]/[M(III)]=2:1基本吻合, 其中M(II)为Fe(II), M(III)为Fe(III)或Al(III)。
根据以上研究可知, 当金属阳极同时释放二价和三价金属离子, 且金属离子的摩尔比为[M(II)]/[M(III)]=2:1时, 即有可能合成水滑石。实验采用两种方式:一是更换电极, 用Mg电极代替Fe电极, 在相同电解条件下, 电解合成LDH; 二是添加金属离子, 仅以Fe为电极, 在电化学系统中添加无法通过电解得到的二价重金属阳离子钴(Co2+)。结果如图 5所示。由图 5可知, 这些改进方式成功地合成了MgAl-LDH和CoFe-LDH。值得注意的是, CoFe-LDH的成功制备是由于阳离子满足LDH的基本结构要求, 其中LDH阳离子层中的Fe为三价阳离子, 说明Fe离子在该系统中具有化合价可变化的特性。上述研究证明了电化学工程方法具有可扩展性, 这种制造技术在扩大反应器尺寸后很容易推广。
3.2 Fe/Al-LDHs成核机制探究
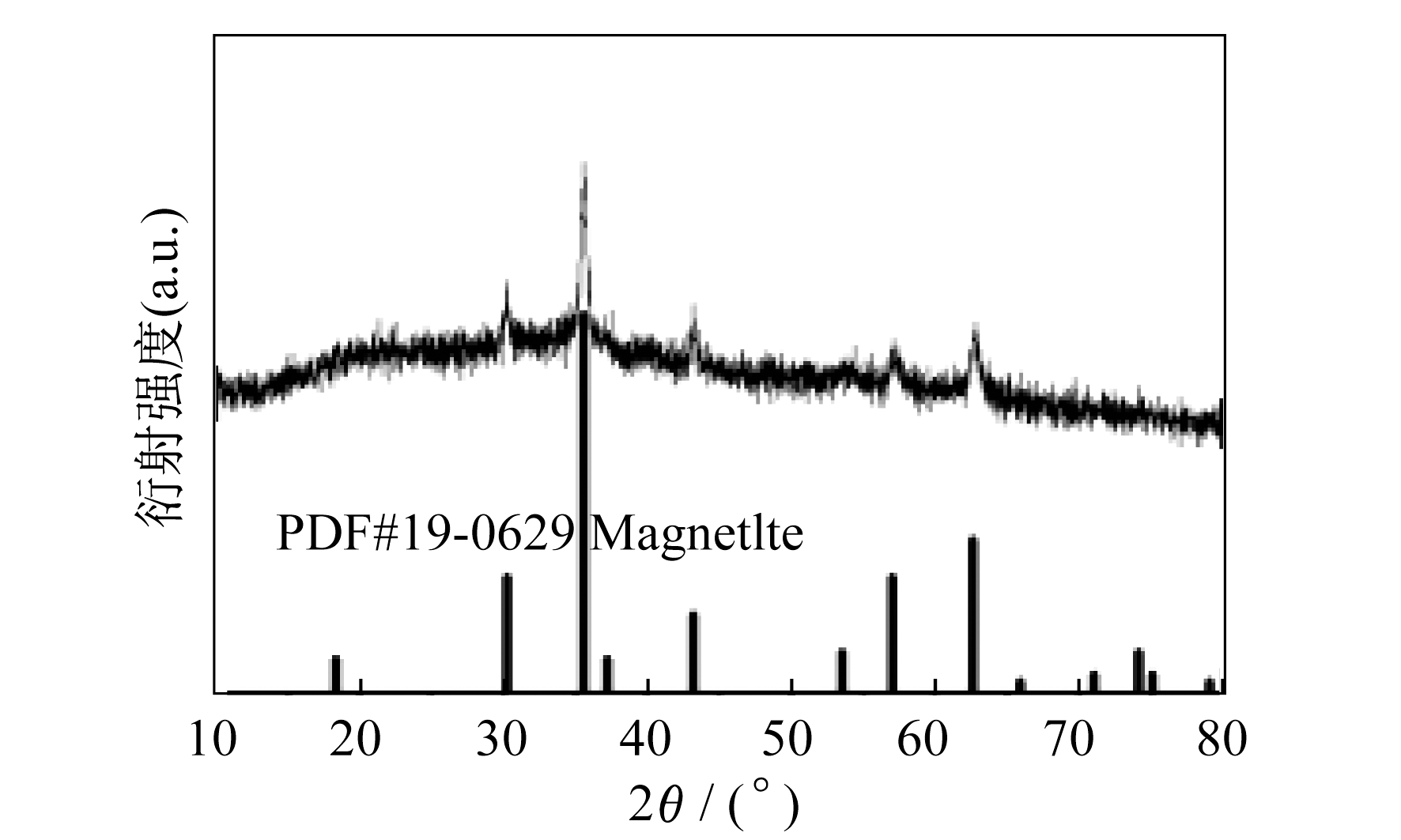
根据上述CoFe-LDH的成功制备可以发现, 电化学系统中Fe的价态可以是二价或三价。当电化学系统中只使用Fe电极而不存在Al电极时, 最终产物是磁铁矿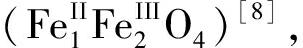 而不是Fe/Fe-
而不是Fe/Fe-
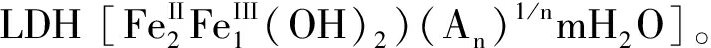 这表明大部分Fe在该电化学系统中的价态为三价, 具体如图 6所示。
这表明大部分Fe在该电化学系统中的价态为三价, 具体如图 6所示。
我们进一步尝试通过改变两个电源的输出电流来研究[Fe]/[Al]的不同摩尔比, 其形貌如图 7所示。
由图 7可知, 当有Al存在时, 无论比例多少, 电化学系统中一定会生成Fe/Al-LDH纳米片。当[Fe]/[Al]=1时, Al含量过剩, 过量的Al保留在上清液中, 见图 7(a)。但随着[Fe]/[Al]摩尔比的增大, 即Fe3+逐渐过量时, 磁铁矿的比例在最终产物中的占比逐渐增加, 此时在上清液中几乎没有发现Al离子(数据未显示)。
Fe/Al-LDHs在电化学系统中的生长, 可以用经典的共沉淀机理来解释[9]。系统通电后, 阳极电解失电子, 发生氧化反应; 阴极表面的水得电子, 生成OH-离子和氢气, 发生还原反应。金属离子在阳极失电子后形成金属离子溶解在水中, 并且从阴极形成OH-离子, 此时生成的金属阳离子与阴极的OH-离子结合, 发生共沉淀反应, 进而形成水滑石。在此过程中, 两种不同金属氢氧化物沉淀顺序对形成LDH的前驱体有很大影响, 而这种LDH的异质成核在动力学上是有利的。系统中3种金属氢氧化物的沉淀平衡常数Ksp分别是:Ksp[Al(OH)3]=1.3×1033, Ksp[Fe(OH)2]=1.64×1014, Ksp[Fe(OH)3]=1.1×1036。其中, Al(OH)3的Ksp最大, 会先沉淀并成为Fe/Al-LDHs成核的前驱体, 随后不断结晶形成Fe/Al-LDHs。由于Al的结晶性较弱[10], 所以当Al存在且作为晶核时, Fe/Al-LDHs的结晶性也较弱, 与图 3的测试结果保持一致。当系统中的Fe(II)充分过量时, 所有Al(III)都被消耗, 过剩的Fe(II)在溶液中不稳定并最终形成Fe(III)含量较高的磁铁矿。
4 结论
牺牲双阳极法的研究提供了一种只使用电解质和电来制备LDH纳米薄片的新方法, 而不是引入金属盐, 具有操作简便、合成快速等优点。成功生成高纯度Fe/Al-LDH的关键是良好的阳极组合和对金属溶解量的精确控制(通过控制i和[Fe]/[Al]的摩尔比), 从而避免磁铁矿和Fe2O3等不稳定Fe(II)副产物的出现。Fe/Al-LDHs的具体形成过程可以概括如下。
(1) 阳极溶解的Al先与阴极生成的大量羟基离子形成Al(OH)3, 有助于减轻铁羟基离子的影响。
(2) 由于Al(OH)3表面的离子电荷不平衡, 溶液中的Fe(II)被吸附在位点上, 然后连续结晶, 有效避免了添加金属盐及高温烧制的要求。制备过程快速简单, 在应用上极具潜力。
参考文献
-
[1]PREVOT V, FORANO A, BESSE J P. Hydrolysis in polyol: new route for hybrid-layered double hydroxides preparation[J]. Chemistry of Materials, 2005, 17(26): 6695-6701. DOI:10.1021/cm050581x
-
[2]ZHONG Y, YANG Q, LUO K, et al. Fe(II)-Al(III)layered double hydroxides prepared by ultrasound-assisted co-precipitation method for the reduction of bromated[J]. Journal of Hazardous Materials, 2013, 250/251: 345-353. DOI:10.1016/j.jhazmat.2013.01.081
-
[3]ZHAO Y, LI F, ZHANG R, et al. Preparation of layered double-hydroxide nanomaterials with a uniform crystallite size using a new method involving separate nucleation and aging steps[J]. Chemistry of Materials, 2002, 14(10): 4286-4291. DOI:10.1021/cm020370h
-
[4]XU Z P, LU G Q. Hydrothermal synthesis of layered double hydroxides(LDHs)from mixed MgO and Al2O3: LDH formation mechanism[J]. Chemistry of Materials, 2005, 17(5): 1055-1062. DOI:10.1021/cm048085g
-
[5]EIICHI N, KAVIRATNA P D, PINNAVAIA T J. Direct synthesis of a polyoxometallate-pillared layered double hydroxide by coprecipitation[J]. Journal of the Chemical Society, Chemical Communications, 1993(1): 60-62. DOI:10.1039/c39930000060
-
[6]PAN C, TROYER L D, CATALANO J G, et al. Dynamics of chromium(VI)removal from drinking water by iron electrocoagulation[J]. Environmental Science & Technology, 2016, 50(24): 13502-13510.
-
[7]XU Z P, BRATERMAN P S. Synthesis, structure and morphology of organic layered double hydroxide(LDH)hybrids: comparison between aliphatic anions and their oxygenated analogs[J]. Applied Clay Science, 2010, 48(1/2): 235-242.
-
[8]CABRERA L, GUTIERREZ S, MENENDEZ N, et al. Magnetite nanoparticles: electrochemical synthesis and characterization[J]. Electrochimica Acta, 2008, 53(8): 3436-3441. DOI:10.1016/j.electacta.2007.12.006
-
[9]BERGMAN G, WAUGH J L T, PAULING L. The crystal structure of the metallic phase Mg32(Al, Zn)49[J]. Acta Crystallographica, 1957, 10(4): 254-259. DOI:10.1107/S0365110X57000808
-
[10]BYRNE R H, LUO Y R. Direct observations of nonintegral hydrous ferric oxide solubility products: K*so=[Fe3+][H+]-2.86[J]. Geochimica et Cosmochimica Acta, 2000, 64(11): 1873-1877. DOI:10.1016/S0016-7037(00)00329-X