|
|
|
发布时间: 2023-02-28 |
综合能源管理 |
|
|
|
收稿日期: 2022-04-22
基金项目: 国家青年自然科学基金(52005315)
中图法分类号: TB31
文献标识码: A
文章编号: 2096-8299(2023)01-0061-06
|
摘要
目前非铂的合金催化剂已成为研究重点。Cu/Ag合金通过各组分间的协同作用能够增强其催化活性, 降低催化剂成本, 有实际的应用价值。利用Material Studio软件进行Cu/Ag双金属的不同晶面结构的能带、态密度以及对水分子吸附能的研究, 以确定不同晶面的催化活性。结果表明, 当铜(Cu)在上、银(Ag)在下的layer 2结构, 以及水分子吸附在铜原子还是吸附在银原子两种情况下, 吸附能均为负值, 吸附体系均稳定, 表明该结构具有最好的电催化性能。
关键词
吸附能; 合金催化剂; 铜/银; 第一性原理
Abstract
The research of alloy catalyst has become a research focus.Cu/Ag alloy is more easily controllable in composition, and its catalytic activity can be enhanced through the synergistic effect among the components.At the same time, the cost of catalyst is reduced, which makes it more practical in the field of catalysis.In this paper, the energy band and density of states of Cu/Ag with different structures are calculated by Material Studio software, and the stability of water molecules adsorption with different structures is studied.The results show that the adsorption energy of structure with silver at the top and silver at the bottom is negative.When the water molecule is adsorbed on copper or silver atoms, the adsorption system is stable, indicating that the structure has the best electrocatalytic performance.
Key words
adsorption energy; alloy catalyst; Cu/Ag; first principles
质子交换膜燃料电池被广泛用于工业生产和日常生活。但是由于电催化剂的成本使其应用发展受到限制, 开发低铂或非铂的金属催化剂成为了催化剂研究的重点[1-2]。
催化剂可以分为单金属催化剂和双金属催化剂[2-3]。单金属催化剂是指催化剂仅含单一金属成分, 如铑可用来控制汽车相关行业的废气排放或加氢反应等; 多金属催化剂是指催化剂中含有两种或者两种以上的金属, 如Cu/Ag, Cu/Pt, Cu/Co, Ag/Pd, Ag/Au, Ag/Co Ni/Cu, Pd/Au, Cu/Au和Pt/Ir等[4-11]。Cu/Au电催化剂具有高效的电催化能力; Ni/Cu合金催化剂具有高催化活性、选择性以及稳定性等; Cu/Ag合金更容易在组分上实现可控, 通过各组分间的协同作用能够增强其催化活性, 同时也能降低催化剂成本, 从而使其在催化领域更具有实际的应用价值。通过理论和实验研究, 已经证明了Cu/Ag合金具有更高的氧化还原反应性能。文献[12]通过密度泛函理论计算表明Cu/Ag复合物具有更高的氧气吸附能力和更低的氧气脱附阻力。吸附是电催化反应的基本步骤, 催化剂只有能够吸附化学反应物才能起催化作用。本文通过研究Cu/Ag复合物对水分子的吸附能力来表征其催化能力。首先通过Moderial Studio软件建立了铜和银晶胞结构, 然后建立了Cu/Ag层状结构和取代结构两种模型, 研究其能带、态密度以及对水分子的吸附性能。
1 模型构建
为了计算和分析铜银合金催化剂的性能和对水分子的吸附性能, 考虑到不同结构下其性能会有不同, 故建立多种结构并进行对比分析。
1.1 层状的Cu/Ag合金模型
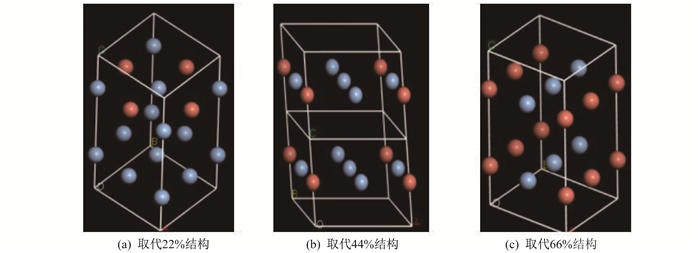
1.2 Cu原子取代部分Ag原子的取代晶体模型
首先, 选取银原子构成的晶胞, 对其进行几何优化直至收敛, 并进行切面计算。然后, 建立由两层银原子构成的真空层, 并将部分银原子用铜原子取代。3种取代结构的晶格模型如图 2所示。
1.3 建立水分子吸附模型
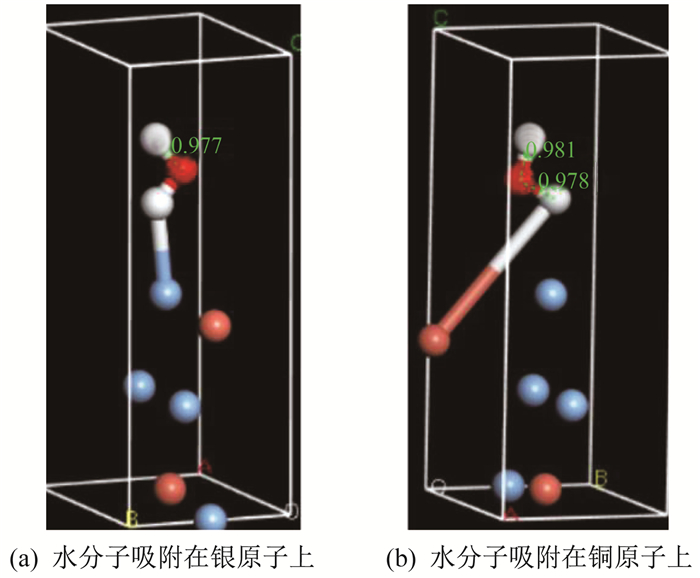
首先, 对层状结构和取代结构优化后对所建结构进行Morphology Calculation模块计算。发现layer 1和layer 2最可能暴露的面是(0 0 1)面和(0 0-1)面。其次, 选择(0 0 1)面进行切割, 并在切割完后建立一个高度约为0.6 nm、厚度约为0.15 nm的真空层, 并对其进行几何优化, 转化表现形式为原胞模型。最后, 通过考察两种吸附方式下的吸附能(一种吸附方式是水分子直接吸附在模型的银原子上, 另一种是水分子直接吸附在铜原子上)。吸附模型几何优化收敛后的具体情况如图 3所示。
由图 3可知, 吸附完成后的水分子键长也发生了变化, 原子间的距离变化意味着能量和原子活性也发生了变化。
针对银原子取代程度为44%的结构模型, 模块计算选取最大可能的(1-1 0)面, 占比70.3%左右, 剩下的则是占比29.7%的(0 0 1)面。选择最大可能性的(1-1 0)面, 进行切面, 建立真空层并进行几何优化直至收敛。添加水分子再次进行几何优化得到如图 4所示的两种不同的水分子吸附模型。
由图 4可知, 吸附在银原子上的水分子远银端键长要比吸附在铜原子上的水分子远铜端更小, 说明远银端氢原子的活性更弱, 推测水分子吸附在银原子上要比吸附在铜原子上更加稳定。
2 计算结果与讨论
2.1 层状结构的能带和态密度
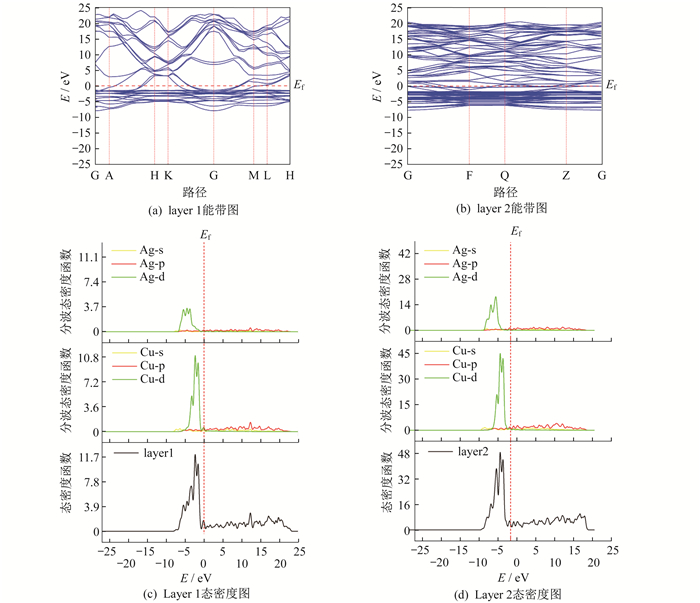
针对layer 1和layer 2两种结构, 选择GGA-PBE泛函理论, 在能带计算路径中, 选取的是G—A—H—A—K—G—M—L—H路径。其能带和态密度的计算结果如图 5所示。图 5中, Ef指费米能级。
从layer 1的能带图和态密度图可以看出, 铜原子在d轨道上做出的贡献要大于银原子, 而两者在s轨道和p轨道上几乎差别不大。在能带较宽、态密度较为平缓处则说明该轨道处可能成键较强。
从layer 2的能带图和态密度图可以看出, 图中的能带平缓, 由此推测态密度应该较为尖锐, 说明在对应能量处有较多的电子分布; 铜原子和银原子均在d轨道上有较大的贡献, 且铜原子在d轨道上的贡献要明显大于银原子, 而二者在s轨道和p轨道上贡献均较小, 贡献差别也不大。
2.2 层状结构的水吸附性能
通过对层状结构吸附水分子进行吸附能计算, 分别考虑吸附在铜原子和银原子两种吸附情况下的吸附能。根据吸附能计算公式, 吸附能=吸附后体系总能-吸附前体系各部分能量的加和。水分子的吸附能为-2.785 998 42×104 eV, layer 1和layer 2结构的吸附前后的能量如表 1所示。
表 1
layer 1和layer 2结构的水吸附能
| 结构 | 吸附水分子前结构能量 | 水分子吸附在银原子上后的能量 | 水分子吸附在铜原子上后的能量 |
| layer 1 | -1.137 357 21 | -1.184 464 22 | -1.184 003 92 |
| layer 2 | -2.946 522 53 | -2.993 600 46 | -2.993 722 51 |
由表 1可知, 当水分子吸附在layer 1结构中的银原子上时, 其吸附能为-0.756 448 eV。由于吸附能为负值, 所以可以看出该吸附过程为放热过程。这种吸附模型的吸附体系还是比较稳定的。当水分子吸附在layer 1结构中的铜原子上时, 其吸附能为3.846 652 eV。由于吸附能为正值, 所以可以看出该吸附过程为吸热过程, 且这种吸附模型形成后的吸附体系不稳定。
当水分子吸附在layer 2结构中的银原子上时, 其吸附能为-0.465 548 eV。由于吸附能为负值, 所以该吸附过程为放热过程, 这种吸附体系是稳定的。当水分子吸附在layer 2结构中的铜原子上时, 其吸附能为-1.686 048 eV。由于吸附能为负值, 所以可以推断整个吸附过程为放热过程, 整个吸附体系比较稳定。
由此可见, layer 2结构中水分子在铜原子上的吸附能最低, 说明该结构更有利于电催化反应。
2.3 取代结构的能带和态密度分析
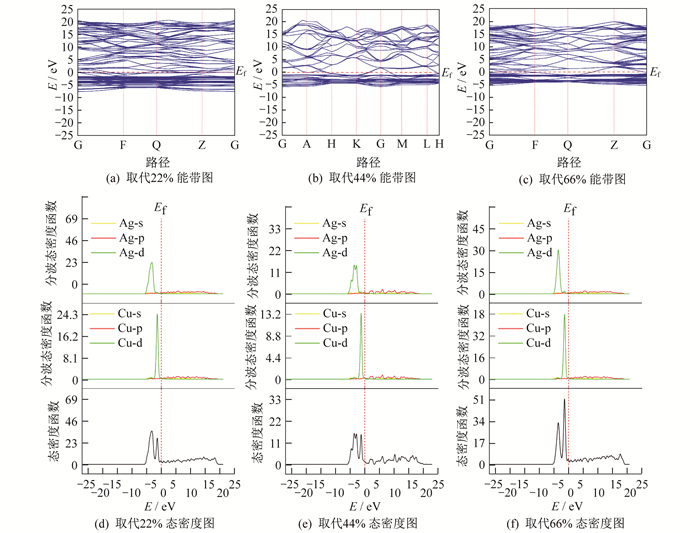
对建立的取代结构进行能量性能分析, 设置能带计算路径为G—F—Q—Z—G。得到的不同取代结构能带和态密度图, 如图 6所示。图 6中的Et也是指费米能级。
由图 6可知: 取代22%的能带图整体较为平缓, 由于是固体金属故带隙为零; 同时从其态密度图能够发现与层状结构类似的是铜原子和银原子, 在d轨道上的电子数量相对分布贡献均较大, 不同的是铜原子在-1 eV处的电子分布数量占比达到最大, 相对值达到了24.3左右, 银原子则是在-4 eV处达到了最高相对值34.0左右, 远高于层状结构的电子数量分布。同时, 不同结构中相同原子在s轨道、p轨道和d轨道的占比影响很小, 但是对于相同轨道的电子数量分布占比却影响较大。
取代44%结构的能带波动较大, 由于原子特性, 铜原子和银原子在d轨道上的电子数量分布占比依旧保持最大, 或者说贡献最大。在p轨道和s轨道上的占比较小, 但是很明显, 不同结构会让占比发生一定量的变化。就同一取代结构而言, 在银原子取代程度44%的情况下, 银原子在d轨道上的占比相对值约在15.0, 能量处于-3 eV, 铜原子在d轨道上的占比相对值约在13.2, 能量处于-1 eV, 两者占比近乎持平。
对于取代66%结构, 进行能量性质计算并绘制能带图, 能带计算路径为G-F-Q-Z-G, 从其态密度图中可以看出铜原子在d轨道上的电子数量分布相对占比已经高于银原子在d轨道上的电子数量占比, 当能量处于-4 eV时, 银原子在d轨道上的占比达到峰值, 铜原子则在-1.5 eV处占比达到峰值。
2.4 取代结构的水吸附性能研究
通过对不同取代结构的吸附水分子进行吸附能计算, 分别考虑吸附在铜原子和银原子两种吸附情况下的吸附能, 结果如表 2所示。
表 2
不同取代结构的水吸附能
| 结构 | 未吸附水分子前的结构能量 | 吸附在银原子上后的结构能量 | 吸附在铜原子上后的结构能量 |
| 取代22% | -2.739 085 35 | -2.785 998 42 | -2.832 910 40 |
| 取代44% | -1.938 142 71 | -1.985 313 97 | -1.985 159 96 |
| 取代66% | -2.274 042 17 | -2.321 057 64 | -2.321 076 04 |
通过吸附能计算公式得到3种结构下水分子吸附在银原子上的吸附能分别为1.183 052 eV、-1.398 848 eV、0.159 052 eV。由此可知: 取代22%和取代66%结构的水分子在银原子上的吸附能均为正值, 所以该吸附过程为吸热过程, 吸附体系较不稳定; 取代44%结构的水分子在银原子上的吸附能为负值, 吸附过程为放热过程, 体系稳定。
同时, 根据吸附能计算公式发现: 取代22%结构的水分子吸附在铜原子上的吸附能为235.751 127 eV, 由于吸附能为正值, 故该吸附过程为吸热过程, 整个吸附体系较不稳定。平均到每个水分子的吸附能都有235.751 127 eV, 不难发现吸附能远大于非周期性吸附结构, 考虑到吸附呈现周期性对称结构比较困难, 故吸附难易性不加入整体对比考虑。取代44%结构的水分子吸附在铜原子上的吸附能为0.141 252 eV, 吸附能为正值, 吸附体系不稳定。取代66 %结构的水分子吸附在铜原子上的吸附能为-0.024 948 eV, 吸附能为负值, 吸附体系稳定。
3 结语
通过第一性原理计算发现, 不同结构的能带和态密度均有所不同。进一步对水分子吸附能进行研究发现, layer 2结构对水分子吸附在铜原子还是吸附在银原子上, 其吸附能均为负值, 吸附体系均是稳定的; 且该结构中水分子在铜原子上的吸附能最低, 为-1.686 048 eV, 表明该结构具有最好的电催化性能。
参考文献
-
[1]王俊美. 低铂合金纳米材料微结构与电催化性能相关性研究[D]. 北京: 北京科技大学, 2021.
-
[2]李瑞松, 刘亚琳, 田浩, 等. 燃料电池中铂基电催化剂的设计与合成[J]. 化工进展, 2021, 40(9): 1-19. DOI:10.16085/j.issn.1000-6613.2021-0402
-
[3]田明华, 李巧霞, 罗莎莎, 等. 燃料电池阳极催化剂的研究进展[J]. 上海电力大学学报, 2021, 37(2): 154-157. DOI:10.3969/j.issn.2096-8299.2021.02.010
-
[4]WU G, MORE K L, JOHNSTON C M, et al. High-performance electrocatalysts for oxygen reduction derived from polyaniline, Iron, and cobalt[J]. Science, 2011, 332: 443. DOI:10.1126/science.1200832
-
[5]刘婧, 陈福义, 张吉晔, 等. 银铜双金属纳米合金的制备和电催化性质[J]. 材料研究学报, 2012, 26(1): 49-54.
-
[6]QASEEM A, CHEN F, WU X, et al. Pt-free silver nanoalloy electrocatalysts for oxygen reduction reaction in alkaline media[J]. Catalysis Science & Technology, 2016(6): 3317-3340.
-
[7]CHOI S, HAN S I, JUNG D, et al. Highly conductive, stretchable and biocompatible Ag-Au core-sheath nanowire composite for wearable and implantable bioelectronics[J]. Nat Nanotechnol, 2018(13): 1048-1056.
-
[8]LIU J, XU C, LIU C, et al. Impact of Cu-Pt nanotubes with a high degree of alloying on electro-catalytic activity toward oxygen reduction reaction[J]. Electrochimica Acta, 2015, 152: 425-432. DOI:10.1016/j.electacta.2014.11.133
-
[9]LIU P, HU Y, LIU X, et al. Cu and Co nanoparticle-Co-decorated N-doped graphene nanosheets: a high efficiency bifunctional electrocatalyst for rechargeable Zn-air batteries[J]. Journal of Materials Chemistry A, 2019(7): 12851-12858.
-
[10]ZHANG Y, LI J, RONG H, et al. Self-template synthesis of Ag-Pt hollow nanospheres as electrocatalyst for methanol oxidation reaction[J]. Langmuir, 2017, 33: 5991-5997. DOI:10.1021/acs.langmuir.7b00647
-
[11]LEE S, PARK G, LEE J. Importance of Ag-Cu biphasic boundaries for selective electrochemical reduction of CO2 to ethanol[J]. ACS Catalysis, 2017(7): 8594-8604.
-
[12]SHIN K, KIM D H, YEO S C, et al. Structural stability of AgCu bimetallic nanoparticles and their application as a catalyst: a DFT study[J]. Catalysis Today, 2012, 185: 94-98. DOI:10.1016/j.cattod.2011.09.022