|
|
|
发布时间: 2023-02-28 |
综合能源管理 |
|
|
|
收稿日期: 2022-03-28
中图法分类号: TQ028.2
文献标识码: A
文章编号: 2096-8299(2023)01-0080-05
|
摘要
光催化还原技术可以将CO2气体转化成高附加值有机物, 实现CO2资源化利用。TiO2作为常见的光催化材料, 具有价格低廉、化学稳定性高等优点。虽其自身的光谱响应范围较窄, 且其电子空穴复合率太高, 导致其作为光催化材料的催化效率大大降低, 但可以通过半导体复合的方式提高其光催化性能。以硫脲和二水氯化铜团制备出硫化亚铜Cu2S-TiO2-X, 通过高温水热复合到基体上, 通过X射线衍射、X射线电子能谱、扫描电镜、紫外光可见光分度计等表征手段研究了其物理特性, 并进行了CO2还原实验。结果表明: Cu2S-TiO2-1.0的光催化还原性最强, 其CH4产率为0.12 μmol/(g·h); 随着Cu2S含量的减少, CH4产率先增加后减少。
关键词
二氧化碳; 二氧化钛; 硫化亚铜; 光催化还原
Abstract
Photocatalytic reduction technology can convert CO2 gas into high value-added organics and realize the resource utilization of CO2.As a common photocatalytic material, titanium dioxide has the advantages of low price and high chemical stability.However, its own spectral response range is narrow, and its electron hole recombination rate is too high, which leads to its catalytic efficiency as a photocatalytic material is greatly reduced, and its photocatalytic performance can be improved by semiconductor recombination.In this paper, cuprous sulfide Cu2S-TiO2-X is prepared from thiourea and copper chloride dihydrate.It is compounded to the matrix by high temperature alcoholysis.Its physical properties are studied by means of X-ray diffraction, X-ray electron spectroscopy, scanning electron microscopy, ultraviolet visible light graduator and other characterization methods.The results show that: the photocatalytic reduction of Cu2S-TiO2-1.0 is the strongest and its CH4 yield is 0.12 μmol/(g·h).With the decrease of Cu2S content, The CH4 yield increases first and then decreases.
Key words
carbon dioxide; titanium dioxide; cuprous sulfide; photocatalytic reduction
大量化石燃料燃烧会造成大量CO2排放, 产生温室效应。面对这一突出的环境问题以及低碳技术规划应对能力不足的特点, 寻找一种将CO2转化的技术方法就成为了解决温室效应的最佳方案。目前将CO2转换成其他物质的技术路线主要有电催化、热催化以及光催化[1-7]。电化学还原是通过阴极和阳极等通电装置, 在溶液体系中将CO2转化成CO和CxHy等物质[8-9]。其基本过程可以分为3个步骤: 一是CO2分子吸附到催化剂表面; 二是在电极的作用下, 发生电子/质子迁移; 三是CO2被转化成CO和CxHy等物质。电化学还原虽然可以使CO2合成多种产物, 但产物选择性相对较低且还原产物效率也较低, 也会消耗大量的电能, 同时, 将CO2转化成高附值的有机物, 不仅要消耗电能, 而且也会产生部分CO2。热催化还原CO2[10-12]主要是CO2气体在较低温度(≤523 K)的加氢反应, 生成甲烷(CH4)、一氧化碳(CO)、烃类、醇类等高附加值的有机物。该方法存在一些应用上的局限, 如反应物H2通常比CH4更具有社会价值; 虽然可以通过加氢将CO2转化成CO, 之后利用费托法将CO转化成长链高附加值有机物, 但在此反应阶段, 需要投入大量的基础建设, 会增加运行成本; CO2转化成甲醇的产率较低。以上种种制约因素导致热催化在实际的应用中存在很大的局限性。
光催化还原CO2是利用太阳能将CO2转化成高附加值的有机物。入射光照射半导体催化材料, 产生电子-空穴对, 利用电子-空穴的氧化还原性将CO2转化成CO, CH4, HCOOH, CH3OH或其他烃, 以及将水氧化成O2。光催化技术的能量来源于太阳光, 在实现CO2资源化的同时, 没有增加其他额外能源的投入, 是一种比较理想的方法[13-15]。TiO2作为常见的光催化材料, 具有价格低廉、化学稳定性高等优点, 但其自身的光谱响应范围较窄, 要通过半导体复合的方式提高其光催化性能。
本文以硫脲和二水氯化铜团制备出硫化亚铜, 通过高温水热复合到N型半导体TiO2上。再通过构建P-N异质结结构, 在复合材料内部构建磁场, 以提高电子-空穴效率及CO2转化率。
1 材料制备
1.1 实验原料和试剂
1.2 实验设备和分析仪器
1.3 Cu2S-TiO2复合材料制备
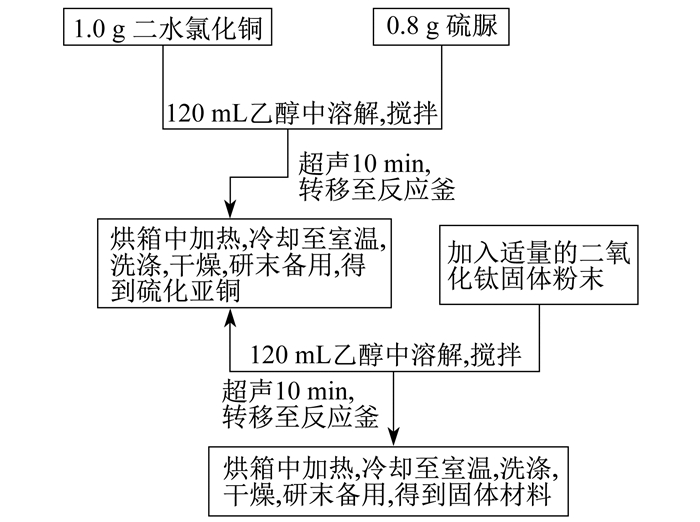
Cu2S-TiO2复合材料制备流程如图 1所示。
Cu2S的制备如下: 采用水热法制备。称取1 g CuCl2·2H2O溶于120 mL无水乙醇, 同时磁力搅拌混合均匀, 记为A溶液; 称取0.8 g CH4N2S加入A溶液, 磁力搅拌10 min, 得到B混合溶液。在超声振荡器中将B混合溶液超声10 min, 超声完毕后转移至聚四氟乙烯水热合成反应釜中, 烘箱温度设定为180 ℃, 时间设定为12 h, 待高压反应釜冷却至室温后, 使用去离子水、无水乙醇分别清洗3遍, 并将洗涤后的样品放置真空干燥箱, 温度设定为60 ℃, 干燥时间设定为24 h。将干燥后的固体研磨备用。
Cu2S-TiO2-X光催化材料的合成过程如下。称取上述Cu2S制备中合成的Cu2S固体0.3 g, 溶于120 mL无水乙醇中, 同时磁力搅拌混合均匀, 记为B溶液。同时分别称取0.5 g、0.8 g、1.0 g、1.2 g、1.5 g TiO2固体, 将称取的TiO2固体分别溶于B溶液, 在磁力搅拌器中混合10 min, 将混合后的溶液转移至超声振荡器中, 超声时间设定为10 min。超声完毕后将溶液转移至150 mL聚四氟乙烯水热合成反应釜中, 烘箱温度设定为180 ℃, 时间设定为12 h, 待高压反应釜冷却至室温后, 使用去离子水、无水乙醇分别清洗3遍, 并将洗涤后的样品放置真空干燥箱, 温度设定为60 ℃, 干燥时间设定为24 h。将干燥后的固体研磨备用。
根据TiO2固体加入量的不同, 分别将这批样品命名为Cu2S-TiO2-0.5、Cu2S-TiO2-0.8、Cu2S-TiO2-1.0、Cu2S-TiO2-1.2、Cu2S-TiO2-1.5, 并将这一批样品整体命名为Cu2S-TiO2-X。
2 Cu2S-TiO2材料表征分析
2.1 X射线衍射分析(XRD)
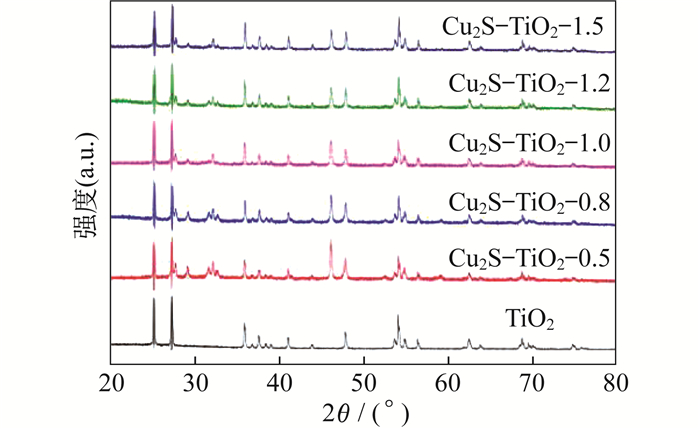
TiO2和Cu2S-TiO2-X系列样品的X射线衍射分析(XRD)如图 2所示。
由图 2可知, 制备的Cu2S-TiO2-X样品在27.67°、32.14°、46.13°出现了较强的衍射峰, 分别与JCPDS 24-0061 Cu1.8S(蓝辉铜矿材料, Cu2S中一种结构)的(111)、(200)、(220)晶面高度吻合, 说明合成了不规则的颗粒团聚结构的Cu1.8S。样品Cu2S-TiO2-X在27.26°、35.90°、47.88°、56.47°、68.85°与TiO2的(110)、(101)、(200)、(220)、(301)晶面衍射数据一致。对比TiO2及Cu2S-TiO2-X系列样品的XRD图, 发现Cu2S和TiO2的特征衍射峰同时出现, 不存在其他杂质的峰。随着Cu1.8S复合比例的不断提高, 在2θ为27.67°、32.14°、46.13°特征峰逐渐增强。随着Cu1.8S含量的减少, 35.90°的衍射峰逐渐增强, 且TiO2的特征峰也逐渐变得尖锐, 说明Cu1.8S负载后, TiO2的结晶度有所提高, 可能是二者之间形成了异质结结构, 表明Cu1.8S与TiO2成功复合。
2.2 扫描电镜(SEM)分析
对制备的Cu2S-TiO2-X材料进行扫描电镜(SEM)分析, 结果如图 3所示。
由图 3(a)可以看出, 水热合成的Cu2S组成不规则的颗粒成团聚状结构, 与文献[16-17]合成的Cu1.8S(JCPDS 24-0061)晶貌结构一致。由图 3(b)可以看出, TiO2(P25)的形貌与晶体结构是大量不规则交加叠加的片状。由图 3(c)~图 3(g)可以看出, 制备合成的5种Cu2S-TiO2-X在其大量不规则交加叠加的片状结构上有明显的不规则的颗粒团聚结构, 说明Cu2S已经成功负载到TiO2。随着Cu2S与TiO2含量比的变化, 其形貌上也发生了变化: 随着Cu2S含量的减少, Cu2S负载到TiO2的晶格尺寸也发生变化, 主要表现为Cu2S的颗粒尺寸变小。这可能是TiO2在Cu2S表面产生“包覆作用”, 阻碍了Cu2S晶体结构的形成, 影响了颗粒尺寸的大小。
由上述XRD图和SEM图可知, TiO2在Cu2S表面产生了“包覆作用”。这种作用有可能影响太阳光的利用率和催化材料的活性, 阻碍了CO2与Cu2S催化材料发生反应, 同时其形貌结构也逐渐规则且团聚更加紧密。
2.3 紫外可见漫反射(UV-Vis DRS)分析
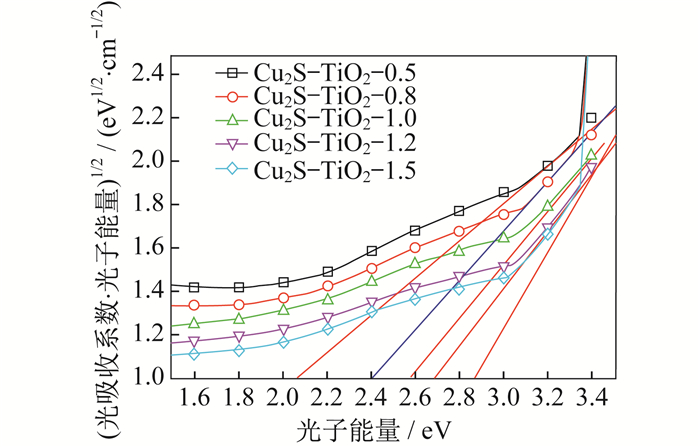
为了研究Cu2S-TiO2-X(X=0.5、0.8、1.0、1.2、1.5)样品的禁带宽度, 实验采用岛津UV3600实验仪器, 研究Cu2S-TiO2-X固体样品的光吸收性能。以光子能量为横坐标, 以(光吸收系数·光子能量)1/2为纵坐标, 其数据的切线与横坐标的交点值为样品禁带宽度值, Cu2S-TiO2-X样品的禁带宽度如图 4所示。
通过将Cu2S负载到TiO2表面, 随着TiO2含量的增加, Cu2S-TiO2-X样品的禁带宽度值逐渐变大。图 4的测试数据表明, Cu2S-TiO2-0.5、Cu2S-TiO2-0.8、Cu2S-TiO2-1.0、Cu2S-TiO2-1.2、Cu2S-TiO2-1.5的禁带宽度分别为2.0 eV、2.4 eV、2.6 eV、2.7 eV、2.8 eV, 远远小于TiO2本身的禁带宽度3.2 eV。通过制备Cu2S-TiO2-X光催化材料, 使得波长大于385 nm的太阳光可以激发体系中的Cu2S, 同时在Cu2S导带中产生电子, 提高材料体系中电子-空穴的分离效率, 促进电荷的分离。
3 Cu2S-TiO2复合材料光催化还原CO2的实验研究
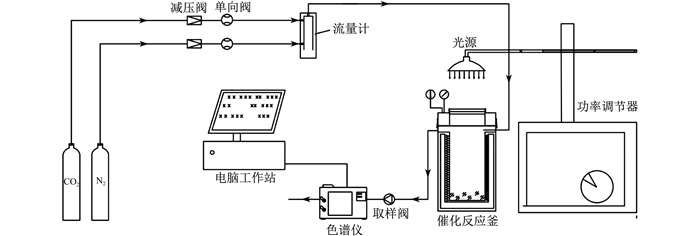
3.1 光催化还原CO2实验系统
光催化还原CO2实验系统如图 5所示。主要由光源、光催化反应釜、行程升降平台、CO2气瓶以及气路等装置组成。光催化反应釜作为CO2反应的装置, 内部安装有磁力搅拌, 可以保证材料与溶液充分混合, 促进CO2在其催化剂表面的吸附。实验系统密封采用双半月牙形卡环和法兰连接结构, 确保实验体系中气体无泄漏危险。该实验站台配置高质量针型阀、三通球阀、压力表, 其中针型阀用于气体产物的收集, 三通阀用于CO2气体的通入。光催化还原CO2反应评价装置是一个密闭的不锈钢反应釜, 其体积为250 mL, 其光源是300 W氙灯, 气体分析采用GC9700(天美制造厂家提供)色谱分析仪。
3.2 实验结果分析
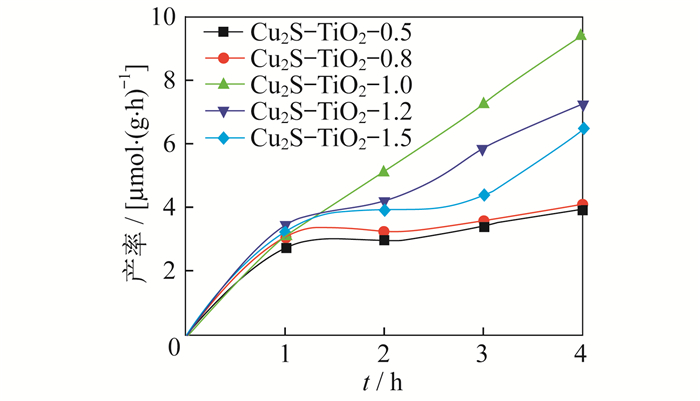
Cu2S-TiO2复合材料光催化还原CO2的产物为甲烷(CH4)。将制备的Cu2S-TiO2复合材料分别作为光催化材料, 放入反应釜中进行光催化还原CO2的实验。具体实验步骤为: 首先将反应釜清洗干燥, 保证无其他碳源的干扰; 然后将100 mL H2O加入反应釜中, 再加入搅拌磁子, 防止局部形成气体的湍流现象; 将0.5 g催化剂放置于反应釜中, 保证均匀分布且直接受光照; 反应开始之前, 用真空泵将反应釜内的空气尽量抽出, 再用氮气(99.999%)吹扫反应釜0.5 h以除去杂质气体且控制反应釜内的压力; 然后连续抽通气几次, 将高纯度CO2气体(99.999%)通入反应釜内并使反应装置内部压力为室压。反应开始阶段, 打开光源并调到相应的光强处, 设置其距离反应釜石英窗口垂直上方2 cm处, 同时打开电磁搅拌器开关搅拌反应物。光催化反应期间, 每间隔1 h从反应釜中抽取气体, 使用装备有TCD和FID检测器的气相色谱仪分析产物气体。实验测试的甲烷(CH4)生成量如图 6所示。
由图 6可知, Cu2S-TiO2-1.0的光催化还原性最强, 其CH4产率为0.12 μmol/(g·h), 随着Cu2S含量的减少, CH4产率先增加后减少。其主要原因是Cu2S与TiO2构成了异质结, 改变了TiO2还原CO2的路径。波长大于385 nm的光子不能有效激发TiO2光催化材料价带电子跃迁至导带, 生成电子-空穴对, 但是可以激发体系中的Cu2S, 同时在Cu2S导带产生电子-空穴, 其空穴通过电子迁移到TiO2导带中, 电子迁移促进了光生载流子的迁移, 促进了电荷的分离, 这与前面的紫外可见漫反射(UV-Vis DRS)表征数据相验证。随着体系中TiO2光催化材料含量的增加, 产生了“屏蔽效应”, 过量的TiO2光催化材料阻隔了光子与Cu2S的接触, 造成了CH4产率的减少。这与前面的SEM晶貌结构中Cu2S晶格大小的变化相一致。
4 结论
(1) 本文主要制备了Cu2S-TiO2-X复合材料, 以这些材料作为催化剂, 通过光催化系统对CO2进行了还原实验, 将CO2还原成CH4。实验使用硫脲与二水氯化铜制备硫化亚铜, 并通过高温水热法制备了Cu2S-TiO2-X。通过控制硫脲与二水氯化铜的比例, 合成了具有不规则颗粒成团聚状晶貌结构的Cu2S材料。
(2) 对复合材料进行了XRD, SEM, UV-Vis DRS等化学表征。由XRD数据可知, Cu2S属于蓝辉铜矿材料。通过SEM表征, 可以看到其晶貌结构为不规则的颗粒成团聚状。UV-Vis DRS测试数据说明, Cu2S负载到TiO2缩短了禁带宽度, 提高了太阳能的利用率。
(3) 光催化还原CO2实验表明, 一定含量的Cu2S提高了TiO2的还原性, 但过量的TiO2会在Cu2S的表面产生包覆作用, 造成“屏蔽效应”。Cu2S-TiO2-1.0的光催化还原性最强, 其CH4产率为0.12 μmol/(g·h), 随着Cu2S含量的减少, CH4产率先增加后减少。
参考文献
-
[1]冯海军, 李芳芹, 任建兴, 等. TiO2改性材料还原CO2的研究进展[J]. 上海电力大学学报, 2020, 36(3): 190-194.
-
[2]JIANG K, ASHWORTH P, ZHANG S Y, et al. China's carbon capture, utilization and storage (CCUS) policy: a critical review[J]. Renewable and Sustainable Energy Reviews, 2020, 119: 109601. DOI:10.1016/j.rser.2019.109601
-
[3]ZHANG Z, WANG T, BLUNT M J, et al. Advances in carbon capture, utilization and storage[J]. Applied Energy, 2020, 278: 115627. DOI:10.1016/j.apenergy.2020.115627
-
[4]XU S Q, DAI S P. CCUS as a second-best choice for China's carbon neutrality: an institutional analysis[J]. Climate Policy, 2021, 21(7): 927-938. DOI:10.1080/14693062.2021.1947766
-
[5]ELISA M, JOSTEIN M, MICHAEL B. Scenarios for carbon capture integration in a waste-to-energy plant[J]. Energy, 2021, 227: 120407. DOI:10.1016/j.energy.2021.120407
-
[6]於琍, 朴世龙. IPCC第五次评估报告对碳循环及其他生物地球化学循环的最新认识[J]. 气候变化研究进展, 2014, 10(1): 33-36.
-
[7]周睿, 韩娜, 李彦光. 铋基CO2还原电催化材料研究进展[J]. 电化学, 2019(4): 445-454.
-
[8]张舒怡, 鲍静娴, 吴博, 等. 甲烷/甲醇光催化转化研究进展[J]. 物理化学学报, 2019, 35(9): 923-939.
-
[9]吴聪萍, 周勇, 邹志刚. 光催化还原CO2的研究现状和发展前景[J]. 催化学报, 2011, 32(10): 1565-1572.
-
[10]DONG W J, TONG Y Z, ZHU B. Semiconductor TiO2 thin film as an electrolyte for fuel cells[J]. Journal of Materials Chemistry A, 2019, 7(28): 16728-16734. DOI:10.1039/C9TA01941C
-
[11]TAN H, HU T T, ZHAGN F Y. Direct metal deposition of satellited TiMo: microstructure and mechanical properties[J]. Advanced Engineering Materials, 2019, 21(8): 1900152. DOI:10.1002/adem.201900152
-
[12]NEGORO N, UMEDA H, HIRSHITA N, et al. Semiconductor device and method of manufacturing the device: US 09231059B2[P]. 2016.
-
[13]FENG Z, MA J W, ZHEGN Z, et al. Study on the absorption of carbon dioxide in high concentrated MDEA and ILs solutions[J]. Chemical Engineering Journal, 2012, 181/182: 222-228. DOI:10.1016/j.cej.2011.11.066
-
[14]SRIDHARAN K, JANG E, PARK T J. Novel visible light active graphitic C3N4-TiO2 composite photocatalyst: synergistic synthesis, growth and photocatalytic treatment of hazardous pollutants[J]. Applied Catalysis B: Environ mental, 2013, 142/143: 718-728. DOI:10.1016/j.apcatb.2013.05.077
-
[15]DE BRITO J F, GENOVESE C, TAVELLA F, et al. CO2 reduction of hybrid Cu2O-Cu/gas diffusion layer electrodes and their integration in a Cu-based photoelectrocatalytic cell[J]. Chem Sus Chem, 2019, 12(18): 4274-4284. DOI:10.1002/cssc.201901352
-
[16]宋长青. Cu2S和VS2纳米结构制备及性能研究[D]. 上海: 华东师范大学, 2014.
-
[17]吴德智. 纳米硫化亚铜及其复合材料的制备、表征与光催化性能研究[D]. 成都: 西南交通大学, 2012.