|
|
|
发布时间: 2023-10-28 |
其他研究 |
|
|
|
收稿日期: 2023-05-26
中图法分类号: TM89
文献标识码: A
文章编号: 2096-8299(2023)04-0507-08
|
摘要
采用一维漂移-扩散流体模型, 对活性粒子在甲酰胺溶液中的传质进行了数值模拟。分析了等离子体处理甲酰胺溶液中5种主要活性氧粒子(OH、OH2、O3、O2-、H2O2)的浓度和渗透深度。结果表明: 在甲酰胺溶液中, O3和OH的渗透深度可以达到13~14 μm, 高于水中的7~9 μm; O2-渗透深度为580 μm, 约为其在水溶液中的50%;甲酰胺浓度在10-5~10-3 mol/L内, 对活性氧粒子传质过程的影响较明显; 溶液中O2对活性氧离子多样性有积极作用。这些现象表明, 可以通过控制实际环境改变活性氧粒子的渗透深度。
关键词
低温等离子体; 活性粒子的传质; 数值模拟
Abstract
The numerical simulation base on a one-dimensional drift-diffusion model.The concentration and penetration depth of five main reactive oxygen species (OH, OH2, O3, O2-, H2O2) are analyzed in the formamide solution of plasma treatment.The penetration depths of O3 and OH increases to 13~14 μm in formamide concentration higher than 7~9 μm in the water.When the concentration and penetration depth of O2- is 580 μm, it is half as much as in the water.When the concentration of formamide ranges from 10-5~10-3 mol/L, the penetration depth of species is more affected.The initial concentration of O2 in the solution also has a positive effect on particle penetration.These phenomena suggest that the penetration depth of species can be changed by controlling the actual environment.
Key words
cold plasmas; mass transfer of reactive species; numerical simulation
大气压低温等离子体(Cold Atmospheric-pressure Plasmas, CAPs)具有较低的温度和良好的反应特性, 在能源、材料、环境、生物医学、农业[1-5]等领域得到了广泛的应用。在等离子体医学中, 治疗伤口、灭杀细菌以及治疗癌症等领域都有涉及CAPs[6-7]。等离子体在临床治疗中具有设备简单、成本低、高效安全、对人体副作用小等优点, 具有良好的应用前景和便捷的使用环境[8]。
等离子体处理溶液时会产生各种活性氧(Reactive Oxygen Species, ROS)和活性氮(Reactive Nitrogen Species, RNS)。这些粒子被认为是等离子体在生物细胞中的主要效应器[9]。其中, 活性粒子的浓度和渗透深度决定了等离子体医学应用的治疗效果和治疗范围[10]。目前, 活性粒子对人体组织的渗透效果引起了人们的广泛关注[11]。仿真通常使用水溶液作为模型, 模拟粒子在液体环境中的传质过程[12]。文献[13]采用一维漂移-扩散流体模型模拟了ROS在水溶液中的传质过程, 发现等离子体受溶液中化学反应影响, 渗透深度可以达到10 μm~1 mm。文献[14]模拟了活性粒子对角质层的渗透, 发现当环境湿润时活性粒子的通透性更强。文献[15]发现随着水溶液模型中O2含量的增加, O3和OH的渗透深度从几微米增加到20 μm, 可直接作用到更深层次生物组织。上述仿真表明, 溶液中活性粒子存在时间和扩散距离较短, 但一些粒子可以通过化学反应达到更深的位置[16-17]。实验方面, 文献[18]研究用水凝胶模拟组织模型监测ROS输送, 发现等离子体渗透深度可超过1.5 mm。文献[19]发现, 用CAPs处理伤口, 可以有效灭杀伤口深处细菌, 激活免疫细胞, 促进组织修复。文献[20]研究发现, CAPs处理伤口激活了伤口内部保护机制, 诱导肌动蛋白的骨架重排形成纤维细胞。上述研究表明, 实验中的活性粒子可以作用到生物组织深处, 但是粒子的渗透过程尚不清晰[21]。仿真方面的研究可以弥补粒子渗透过程的研究, 但是水溶液仍然是比较简单的模型, 不能完全替代组织表面的复杂环境。当CAPs处理生物组织和溶液中细菌时, 液相环境中会存在含有肽键结构的有机物。甲酰胺(NH2CHO)是最简单的肽键模型。文献[22]使用甲酰胺模拟了低能电子对蛋白质肽骨架的碰撞损伤, 发现甲酰胺在一定条件下可以形成核碱基, 是一种潜在的生物前体。文献[23-24]进行了甲酰胺的电子透射谱研究, 发现在2.05 eV时存在强共振, 是由于最低虚分子轨道捕获了电子。文献[25-26]使用静态交换、极化和紧密耦合近似中的r矩阵方法, 计算了低能电子与甲酰胺碰撞的弹性碰撞截面和非弹性激励截面。文献[27]发现, 在0~10 eV的电子冲击能量范围内, 存在2A″对称形状共振, 在肽键和电子间形成稳定的吸附状态。
由于上述仿真中多采用最简单的水溶液作为模型, 实验过程对活性粒子的渗透过程尚不明晰。本文采用一维漂移-扩散流体模型, 研究了CAPs处理甲酰胺溶液过程中的ROS渗透过程。仿真中, 气体放电产生的等离子体中存在短寿命粒子, 包括e、H、O、O(1D)。这些短寿命粒子进入液相后, 在小于1 μm的位置, 与溶液中的O2或H2O快速通过反应消耗, 形成更稳定的长寿命粒子, 包括OH、HO2、O3、O2-、H2O2。这5种稳定的粒子最终可能会到达细胞表面, 并与细胞中成分相互作用, 产生一些医疗效果。本文分析了甲酰胺溶液中5种主要ROS的浓度和渗透深度, 以及溶液中甲酰胺和O2浓度对ROS影响。
1 仿真模型
1.1 等离子体传质模型
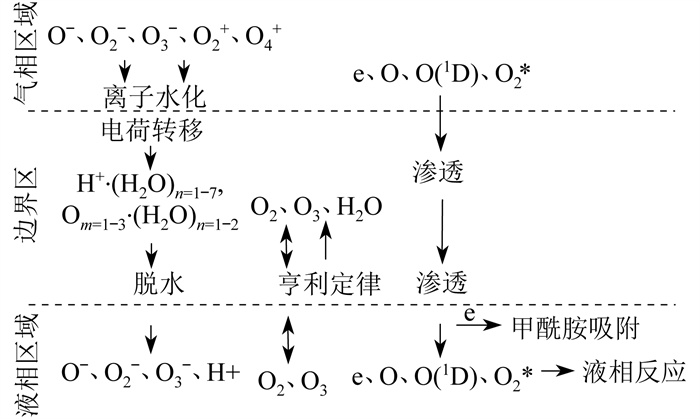
仿真中, 依据参考文献[13]中等离子体源数据, 建立等离子体渗透传质模型。具体如图 1所示。
图 1中, 等离子体发生器模型为He/O2混合物, 氧气浓度为1 %, 气体通量为1 slm[28]。具体实验模型为间隔0.2 cm的平行平板电极之间的放电。具体放电参数为: 振幅511 V、频率13.56 MHz、平均功率密度40 W/cm3。假设液体样本放在其中一个极板上, 用极板间产生的等离子体照射样本, 到达极板的粒子通量就是到达液体表面的通量。
一维漂移-扩散流体模型的构建采用已有的渗透模型。具体如图 2所示。
由图 2可知, 等离子体渗透模型主要分为3个区域。由于理论研究的局限, 所以对气液边界区粒子通量的处理多采用瞬时传质、压力平衡等假设性方法。在实际实验中, 液膜厚度和电场强度对粒子的通量和传质过程都有影响。
1.2 仿真涉及粒子及反应
在文献[12]的基础上建模, 对气液边界区采用瞬时传质、压力平衡、离子水化和脱水假设。水层存在不仅影响活性粒子的转移, 而且对活性粒子的产生和输送也起着至关重要的作用。模型中, 液相厚度为10 mm, O和单线态氧最不稳定, 渗透距离小于1 μm。在气体中各种粒子直接作用在研究对象表面[29]。本文中等离子体进入液体表面的初始浓度如表 1所示[13]。表 1中, a表示臭氧通过亨利定律计算, b表示粒子在液相中生成。
表 1
粒子通过气液边界区的通量及液相中的扩散系数
| 粒子 | 进入液相的通量/(m-2s-1) | 扩散系数/(m-2s-1) |
| e | 9.0×1015 | 1.00×10-1 |
| O- | 7.3×1011 | 2.00×10-5 |
| O2- | 1.4×1011 | 1.97×10-5 |
| O3- | 1.2×1010 | 1.97×10-5 |
| H+ | 8.9×1015 | 9.31×10-5 |
| O | 1.0×1017 | 2.00×10-5 |
| O(1D) | 6.3×1011 | 2.00×10-5 |
| O2(a) | 6.6×1016 | 1.97×10-5 |
| O3 | a | 1.75×10-5 |
| HO2- | b | 1.00×10-5 |
| H- | b | 1.10×10-4 |
| OH- | b | 5.26×10-5 |
| OH | b | 2.30×10-5 |
| HO2 | b | 1.00×10-5 |
| HO3 | b | 1.00×10-5 |
| H2O2 | b | 1.00×10-5 |
| H2 | b | 4.50×10-5 |
| H | b | 4.50×10-5 |
模型中, 设置液体区域的深度为10 mm, pH值为7, 溶液中H+和OH-的浓度为6.02×1019 m-3, 设定环境温度300 K, H2O的浓度为3.35×1028 m-3。假设溶液中O2的浓度为1.642×1023 m-3, 甲酰胺在溶液中的饱和浓度为6.02×1021 m-3。上述粒子的浓度远大于其他粒子, 在仿真中将它们设为常数。表 2为液相中涉及的84个反应方程及对应的化学反应速率, 其中M表示mol/L, 1 mol/L=6.02×1020 cm-3[30-34]。
表 2
液相中化学反应方程和反应速率
| 序号 | 化学反应方程 | 化学反应速率/(s-1或M-1s-1) |
| 1 | O+O2→O3 | 4.0×109 |
| 2 | O+O→O2 | 2.8×1010 |
| 3 | O2(a)+H2O→O2+H2O | 4.9×103 |
| 4 | O2(a)+OH→O2+OH | 2.2×103 |
| 5 | O(1D)+H2O→H2O2 | 1.8×1010 |
| 6 | O(1D)+H2O→2OH | 2.3×10-10 |
| 7 | H++OH-→H2O | 1.4×1011 |
| 8 | H2O→H++OH- | 1.4×10-3 |
| 9 | H2O2→H++HO2- | 1.12×10-1 |
| 10 | H++HO2→H2O2 | 5.0×1010 |
| 11 | H2O2+OH-→HO2-+H2O | 1.3×1010 |
| 12 | HO2-+H2O→H2O2+OH- | 5.8×107* |
| 13 | e+H2O→H2+OH- | 1.9×101 |
| 14 | H+OH-→e-+H2O | 2.2×107 |
| 15 | H→e-+H+ | 3.9* |
| 16 | e+H+→H- | 2.3×1010 |
| 17 | OH+OH→O-+H2O | 1.3×1010 |
| 18 | O-+H2O→OH+OH- | 1.03×108* |
| 19 | OH→O-+H+ | 1.26×10-1* |
| 20 | O-+H+→OH | 1.0×1011 |
| 21 | HO2→O2-+H+ | 1.35×106* |
| 22 | O2-+H+→HO2 | 5.0×1010 |
| 23 | HO2+OH-→O2-+H2O | 5.0×1010 |
| 24 | O2-+H2O→HO2+OH- | 18.5767* |
| 25 | e+OH→OH- | 3.0×1010 |
| 26 | e+H2O2→OH+OH- | 1.1×1010 |
| 27 | e+O2-+H2O→HO2-+OH- | 1.3×1010/[H2O]M-2s-1 |
| 28 | e+HO2→HO2- | 2.0×1010 |
| 29 | e+O2→O2- | 1.9×1010 |
| 30 | 2e+2H2O→H2+2OH- | 5.5×109/[H2O]M-2s-1 |
| 31 | e+H+H2O→H2+OH- | 2.5×1010/[H2O]M-2s-1 |
| 32 | e+HO2-→O-+OH- | 3.5×1010 |
| 33 | e+O-+H2O→OH-+OH- | 2.2×1010/[H2O]M-2s-1 |
| 34 | e+O3-+H2O→O2+2OH- | 1.6×1010/[H2O]M-2s-1 |
| 35 | e+O3→O3- | 3.6×1010 |
| 36 | H+H2O→H2+OH- | 1.1×1010 |
| 37 | H+O-→OH- | 1.0×1010 |
| 38 | H+HO2-→OH+OH- | 9.0×1010 |
| 39 | H+O3-→OH-+O2 | 1.0×1010 |
| 40 | H+H→H2 | 7.8×109 |
| 41 | H+OH→H2O | 7.0×109 |
| 42 | H+H2O2→OH+H2O | 9.0×107 |
| 43 | H+O2→HO2 | 2.1×1010 |
| 44 | H+HO2→H2O2 | 1.8×1010 |
| 45 | H+O2-→HO2- | 1.8×1010 |
| 46 | H+O3→HO3 | 3.8×1010 |
| 47 | 2OH→H2O2 | 3.6×109 |
| 48 | OH+HO2→H2O+O2 | 6.0×109 |
| 49 | OH+O2-→OH-+O2 | 8.2×109 |
| 50 | OH+H2→H+H2O | 4.3×107 |
| 51 | OH+H2O2→HO2+H2O | 2.7×107 |
| 52 | OH+O-→HO2- | 2.5×1010 |
| 53 | OH+HO2-→HO2+OH- | 7.5×109 |
| 54 | OH+O3-→O3+OH- | 2.6×109 |
| 55 | OH+O3-→2O2-+H+ | 6.0×109 |
| 56 | OH+O3→HO2+O2 | 1.1×108 |
| 57 | HO2+O2-→HO2-+O2 | 8.0×107 |
| 58 | HO2+HO2→H2O2+O2 | 7.0×105 |
| 59 | HO2+O-→O2+OH- | 6.0×109 |
| 60 | HO2+H2O2→OH+O2+H2O | 5.0×10-1 |
| 61 | HO2+HO2-→OH+O2+OH- | 5.0×10-1 |
| 62 | HO2+O3-→2O2+OH- | 6.0×109 |
| 63 | HO2+O3→HO3+O2 | 5.0×108 |
| 64 | 2O2-+2H2O→H2O2+O2+2OH- | 1.0×102/[H2O]M-2s-1 |
| 65 | O2-+O-+H2O→O2+2OH- | 6.0×108/[H2O]M-2s-1 |
| 66 | O2-+H2O2→OH+O2+OH- | 1.3×10-1 |
| 67 | O2-+HO2-→O-+O2+OH- | 1.3×10-1 |
| 68 | O2-+O3-+H2O→2O2+2OH- | 1.0×104/[H2O]M-2s-1 |
| 69 | O2-+O3→O3-+O2 | 1.5×109 |
| 70 | 2O-+H2O→HO2-+OH- | 1.0×109/[H2O]M-2s-1 |
| 71 | O-+O2→O3- | 3.6×109 |
| 72 | O-+H2→H+OH- | 8.0×107 |
| 73 | O-+H2O2→O2-+H2O | 5.0×108 |
| 74 | O-+HO2-→O2-+OH- | 4.0×108 |
| 75 | O-+O3-→2O2- | 7.0×108 |
| 76 | O-+O3→O2-+O2 | 5.0×109 |
| 77 | O3-→O2+O- | 3.3×103 |
| 78 | O3-+H+→O2+OH | 9.0×1010 |
| 79 | HO3→O2+OH | 1.0×105 |
| 80 | O+OH-→HO2- | 1.1×105 |
| 81 | H2O2+O→OH2+HO2 | 1.6×105 |
| 82 | H2O2→2OH | 2.3×10-7 |
| 83 | O+HO2-→OH+O2- | 5.3×109 |
| 84 | O3+H2O2→HO2+OH+O2 | 3.0×109 |
1.3 仿真数值基础
在上述液体环境下, 建立粒子在液体中的扩散-反应模型。水溶液中活性粒子的运动和化学反应公式为
| $ \frac{\partial C_{i, l}}{\partial t}=D_{i, l} \frac{\partial^2 C_{i, l}}{\partial x^2}+\sum R_{i, l} $ | (1) |
式中: Ci, l——液相区中反应组分浓度;
Di, l——扩散系数(见表 1);
Ri, l——反应速率, 下标i和l表示对应的粒子和液体。
中性粒子i对应的通量Γi, l为
| $ \mathit{Γ}_{i, l}=-D_{i, l} \frac{\partial C_{i, l}}{\partial x} $ | (2) |
带电粒子受到空间中电场的影响, 需要分成两部分进行考虑, 分别为Γi, diff和Γi, drift。
| $ \begin{aligned} \mathit{Γ}_{i, l}= & \mathit{Γ}_{i, \text { diff }}+\mathit{Γ}_{i, \text { drift }}= \\ & -D_{i, l} \frac{\partial C_{i, l}}{\partial x}+z_i \mu_{i, l} C_{i, l} E \end{aligned} $ | (3) |
式中: zi——离子电荷数;
μi, l——带电物质漂移迁移率;
E——带电粒子建立的静电场。
带电粒子的漂移迁移率μi, l通过能斯特-爱因斯坦方程计算, 为
| $ \mu_{i, l}=\frac{\mathrm{e} D_{i, l}}{k T_l} $ | (4) |
式中: k——玻尔兹曼常数;
Tl——水温。
静电场E用泊松方程来求解, 为
| $ \frac{\partial E}{\partial x}=\sum z_i \mathrm{e} \frac{C_{i, l}}{\varepsilon} $ | (5) |
式中: e——带电粒子电荷;
ε——溶液介电常数。
| $ \begin{gathered} \frac{\partial C_{i, l}}{\partial t}+\nabla \cdot\left(-D_{i, l} \nabla C_{i, l}+z_i \mu_{i, l} C_{i, l} \vec{E}\right)= \\ \sum R_{i, l} \end{gathered} $ | (6) |
液体区域表面x值设为0 mm, 液体区域底部x值设为10 mm。气体区带电粒子的通量Γi, g, 可以认为在靠近边界层的液体表面保持不变, 表达式为
| $ \left.\mathit{Γ}_{i, g}\right|_{x=0}=\left.\left(-D_{i, l} \frac{\partial C_{i, l}}{\partial x}+z_i \mu E C_{i, l}\right)\right|_{x=0} $ | (7) |
部分中性粒子[O、O(1D)、O2(a)]在通过边界区域时, 可以假定与气相区的通量保持一致, 表达式为
| $ \mathit{Γ}_{i, g}=-\left.D_{i, l} \frac{\partial C_{i, l}}{\partial x}\right|_{x=0} $ | (8) |
粒子O2、O3和H2O从气相区到液相区的通量由亨利定律决定, 边界条件为
| $ k_{i, g}\left(C_{i, g}-\left.H_i C_{i, l}\right|_{x=0}\right)=-\left.D_{i, l} \frac{\partial C_{i, l}}{\partial x}\right|_{x=0} $ | (9) |
式中: ki, g——物质在气体区的输运速率;
Hi——亨利系数。
在液相区底部, 假定所有等离子体种类都已达到稳态, 为
| $ \left.D_{i, l} \frac{\partial C_{i, l}}{\partial x}\right|_{x=10}=0 $ | (10) |
在甲酰胺溶液中, 已知甲酰胺与电子的碰撞截面, 利用碰撞理论公式计算甲酰胺的电子吸附反应速率, 为
| $ K={\rm{\mathsf{π}}} d_{A B}^2 L\left(\frac{8 R T e}{{\rm{\mathsf{π}}} \mu}\right)^{\frac{1}{2}} \exp \left(-\frac{E a}{R T}\right) $ | (11) |
式中: πdAB2——碰撞截面;
L——阿伏伽德罗常数;
μ——摩尔等效质量;
Ea——活化能;
exp(-Ea/RT)——有效碰撞分数。
利用设定的边界条件和粒子的碰撞反应关系, 搭建液相区域模型。
2 仿真结果分析
2.1 溶液中ROS的传质过程
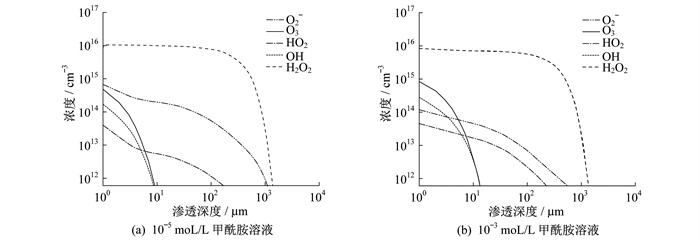
等离子体处理60 s后, 水溶液中5种主要ROS的浓度和渗透深度如图 3所示。
图 3中, 1 μm以下数据没有显示, 这是由于气液边界层为微米尺度, 微米边界层中详细化学成分不确定, 粒子的阈值浓度为6.02×1011 cm-3。图 3(a)为1 mol/L等离子体处理甲酰胺溶液60 s后5种主要ROS的分布情况。从图 3(b)~图 3(f)中可以看出, 水中OH和O3两种重要反应物质的渗透深度为7~9 μm, 与HO2、O2-和H2O2的渗透深度分别为0.19 mm、1.1 mm和1.3 mm。
在浓度为1 mol/L的甲酰胺溶液中, 进入溶液中的电子主要被甲酰胺吸附, 因此这一现象抑制了表 2中电子与其他粒子的相关反应。OH和O3在溶液中的渗透深度有所增加, 但仅仅到达溶液表层下13~14 μm处, 而HO2和H2O2的渗透深度分别为0.23 mm和1.4 mm。O2-渗透深度变化趋势相反, 是因为电子参与形成的反应路径被阻断。O2-参与其他粒子的消耗反应增加, 在10 μm内, O2-和OH的浓度下降趋势明显减缓。
2.2 甲酰胺浓度对ROS的影响
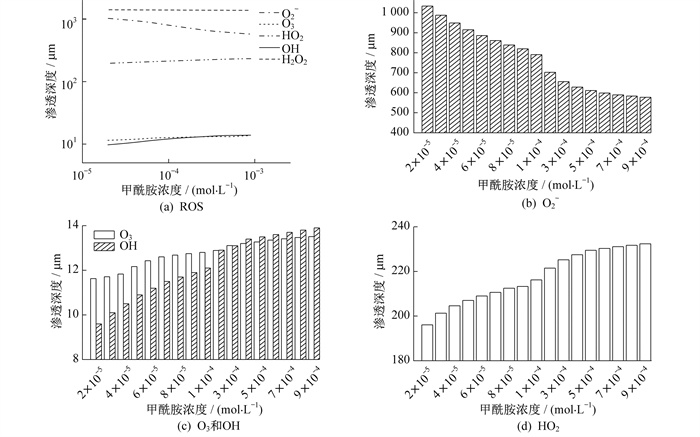
为了分析甲酰胺在等离子体处理溶液中的影响、ROS扩散和化学反应通道的转化过程, 假设前置条件不变, 改变溶液中甲酰胺浓度。结果显示, ROS浓度和渗透深度的主要变化区间为10-5 mol/L到10-3 mol/L, 具体如图 4所示。
在10-5 mol/L和10-3 mol/L之间进行仿真, 得到5种粒子渗透深度随甲酰胺浓度变化的趋势, 具体如图 5所示。
由图 5可以看出, 随着甲酰胺浓度的增加, O3和OH的渗透深度增加了5~7 μm, 且OH渗透深度的增加略快于O3。O2-是溶液中受甲酰胺浓度影响最大的粒子, 其渗透深度从1 033 μm减小到580 μm, O2-在溶液中的生成大幅减少, 消耗量增加。这种情况下, 随着甲酰胺对电子的吸附量增加, 溶液中O2-的渗透深度迅速减小。溶液中HO2渗透深度从200 μm增加到230 μm, H2O2自由基主要由反应HO2-+H2O→H2O2+OH-, 2OH→H2O2和O(1D)+H2O→H2O2提供。H2O2在溶液中的消耗主要由O3+H2O2→HO2+OH+O2和OH+H2O2→HO2+H2O反应引起。但在几微米内, 短寿命粒子O(1D)、O3和较为长寿的OH消耗殆尽。在溶液更深处, 溶液中的HO2-可以通过HO2+O2-→HO2-+O2反应生成, 维持上述第一个反应通道。因此, H2O2浓度在HO2不足时才开始下降, 且甲酰胺溶液中H2O2渗透深度从1 300 μm提高到了1 400 μm。
2.3 O2浓度对ROS的影响
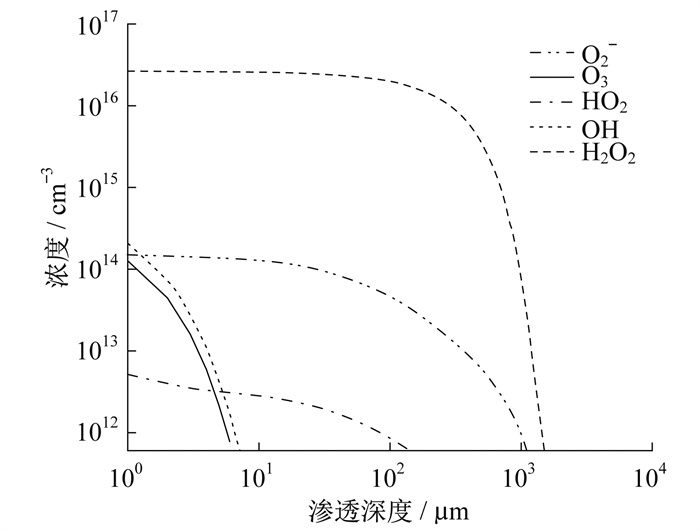
仿真模型的初始条件将溶液中的O2浓度默认为常压下9 mg/L的饱和浓度。假设O2浓度变化对溶液中化学反应速率没有影响, 将溶液中O2浓度调整为0.09 mg/L, 结果如图 6所示。
由图 6可知, H2O2仍然是液相中最重要的ROS。渗透深度表明H2O2传质过程主要取决于粒子自身的扩散速率。反应O+O2→O3受到明显影响, O3浓度低于OH。在两种粒子湮灭前, HO2和O2-的曲线放缓, 表明粒子在该区域的渗透速率增加。总之, 溶液中O2能提高O3和OH的浓度和渗透深度, 较低浓度的O2则有助于H2O2以较高浓度到达溶液底部。
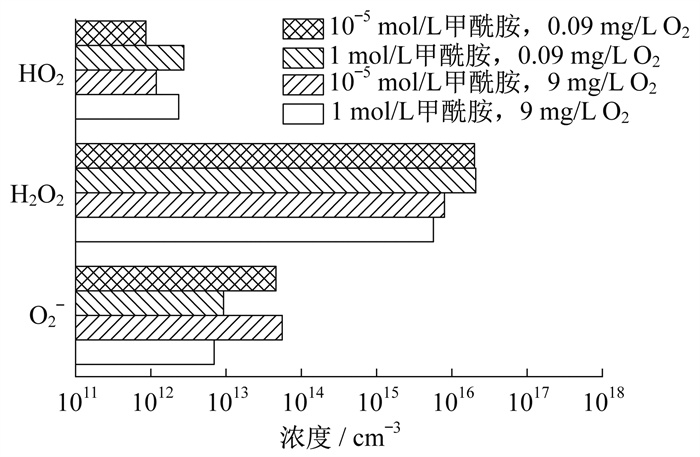
4类甲酰胺溶液环境中100 μm处的3种ROS浓度如图 7所示。
由图 7可知, 较低浓度的甲酰胺有利于O2-粒子渗透, 高浓度的O2有利于ROS多样性分布, 但H2O2的浓度会降低, 只有3种粒子能够到达100微米层。因此, 无论是在类似处理溶液中或者是含大分子蛋白子的液体环境中, 都可以根据不同的要求和环境选择最佳条件。
3 结论
(1) 甲酰胺影响电子的反应路径, 抑制电子和其他活性粒子的化学反应, 进而影响5种主要ROS在溶液中的浓度和渗透深度。
(2) 甲酰胺浓度低于10-5 mol/L时, 其对ROS的影响几乎可以忽略; 浓度高于10-3 mol/L时, ROS浓度和渗透深度趋于稳定。OH和O3的渗透深度随着甲酰胺浓度的增大从7~9 μm增加到13~17 μm, 可以直接作用到更深层组织。
(3) 液相中, O2在不影响H2O2渗透深度的情况下, 促进了ROS的多样性分布。降低O2浓度可以提高到达液相底部H2O2粒子的浓度。这表明通过控制环境, 可以有效调节溶液中ROS的浓度。
参考文献
-
[1]刘文正, 姜希涛, 田甲, 等. 具有内外分段阳极结构的金属离子等离子体推进器的放电特性[J]. 高电压技术, 2023, 49(1): 391-400. DOI:10.13336/j.1003-6520.hve.20220261
-
[2]杨国清, 戚相成, 高青青, 等. 等离子体氟化协同偶联剂改性纳米SiO2/环氧树脂电气性能[J]. 高电压技术, 2022, 48(2): 689-697.
-
[3]高远, 窦立广, 李江伟, 等. 低温等离子体-催化剂协同催化CO2转化进展[J]. 高电压技术, 2022, 48(4): 1607-1619.
-
[4]吴穷, 王豪, 张丽阳, 等. 等离子体产物溶液中扩散与大肠杆菌杀灭[J]. 高电压技术, 2021, 47(3): 826-831. DOI:10.13336/j.1003-6520.hve.20201182
-
[5]赵鑫, 梁烜赫, 崔金平, 等. 等离子体种子处理对不同大豆品种镍吸收及器官分配的影响[J]. 东北农业科学, 2022, 47(3): 37-41.
-
[6]GAO X, HUANG K, ZHANG A, et al. Simultaneous degradation of glucocorticoids and sterilization using bubbling corona discharge plasma based systems: a promising terminal water treatment facility for hospital wastewater[J]. Chemical Engineering Journal, 2022(3): 132817-132845.
-
[7]王梓宸. 等离子体与癌细胞膜相互作用的分子动力学模拟研究[D]. 济南: 山东大学, 2022.
-
[8]TIAN W, KUSHNER M J. Atmospheric pressure dielectric barrier discharges interacting with liquid covered tissue[J]. Journal of Physics D: Applied Physics, 2014, 47(16): 165-201.
-
[9]GRAVES D B. The emerging role of reactive oxygen and nitrogen species in redox biology and some implications for plasma applications to medicine and biology[J]. Journal of Physics D: Applied Physics, 2012, 45(26): 263001. DOI:10.1088/0022-3727/45/26/263001
-
[10]LIU D X, LIU Z C, RONG M, et al. Aqueous reactive species induced by a surface air discharge: heterogeneous mass transfer and liquid chemistry pathways[C]//The 8th International workshop on Plasma. Chengdu, China, 2016: 61-70.
-
[11]LAROUSSI M. Low-temperature plasma jet for biomedical applications: a review[J]. IEEE Transactions on Plasma Science, 2015, 43(3): 703-712. DOI:10.1109/TPS.2015.2403307
-
[12]JIANG J, TAN Z, SHAN C, et al. A new study on the penetration of reactive species in their mass transfer processes in water by increasing the electron energy in plasmas[J]. Physics of Plasmas, 2016, 23(10): 103503. DOI:10.1063/1.4964364
-
[13]CHEN C, LIU D X, LIU Z C, et al. A model of plasma-biofilm and plasma-tissue interactions at ambient pressure[J]. Plasma Chemistry and Plasma Processing, 2014, 34(3): 403-441. DOI:10.1007/s11090-014-9545-1
-
[14]DUAN J, MA M, YUSUPOV, et al. The penetration of reactive oxygen and nitrogen species across the stratum corneum[J]. Plasma Processes and Polymers, 2020, 17(10): 2000005. DOI:10.1002/ppap.202000005
-
[15]丁蕴函, 王晓龙, 谭震宇, 等. 大气压He/O2等离子体活性粒子在水溶液中传质的氧含量效应[J]. 电工技术学报, 2023, 38(11): 2977-2988.
-
[16]LIU Z C, LIU D X, CHEN C, et al. Physicochemical processes in the indirect interaction between surface air plasma and deionized water[J]. Journal of Physics D: Applied Physics, 2015, 48(49): 495201. DOI:10.1088/0022-3727/48/49/495201
-
[17]XU D, LIU D X, WANG B Q, et al. In situ OH generation from O2- and H2O2 plays a critical role in plasma-induced cell death[J]. PloS One, 2015, 10(6): 0128205.
-
[18]SZILI E J, BRADLEY J W, SHORT R D. A 'tissue model' to study the plasma delivery of reactive oxygen species[J]. Journal of Physics D: Applied Physics, 2014, 47(15): 152002. DOI:10.1088/0022-3727/47/15/152002
-
[19]刘阳, 郭鹏, 张楠, 等. 冷等离子体及其在促进皮肤伤口愈合中的研究进展[J]. 实验动物科学, 2022, 39(6): 96-103.
-
[20]ARNDT S, SCHMODT A, KARRER S, et al. Comparing two different plasma devices kINPen and Adtec SteriPlas regarding their molecular and cellular effects on wound healing[J]. Clinical Plasma Medicine, 2018, 9(1): 24-33.
-
[21]刘定新, 何桐桐, 张浩. 等离子体对人体组织的渗透作用: 研究现状与前沿问题[J]. 高电压技术, 2019, 45(7): 14-18.
-
[22]CLOUTIER P, SICARD R C, ESCHER E, et al. Low-energy (3-24 eV) electron damage to the peptide backbone[J]. The Journal of Physical Chemistry B, 2007, 111(7): 1620-1624. DOI:10.1021/jp066947q
-
[23]SEYDOU M, MODELLI A, LUCAS B, et al. Electron attachment to strongly polar clusters[J]. The European Physical Journal D, 2005, 35(2): 199-205. DOI:10.1140/epjd/e2005-00089-5
-
[24]HAMANN T, EDTBAUER A, FERREIRA S, et al. Dissociative electron attachment to gas-phase formamide[J]. Physical Chemistry Chemical Physics, 2011, 13(26): 12305. DOI:10.1039/c1cp20833k
-
[25]WANG Y F, TIAN S X. Low-energy electron collisions with formamide using the R-matrix method[J]. Physical Review A, 2012, 85(1): 012706. DOI:10.1103/PhysRevA.85.012706
-
[26]CARR J M, GALIATSATOS P G, GORFINKIEL J D, et al. UKRmol: a low-energy electron- and positron-molecule scattering suite[J]. The European Physical Journal D, 2012, 66(3): 597-600.
-
[27]BOUDAÏFFA B, CLOUTIER P, HUNTING D, et al. Les électrons de très faible énergie produisent des lésions de l'ADN.[J]. Médecine/Sciences, 2000, 16(11): 1281-1285. DOI:10.4267/10608/1574
-
[28]YANG A, WANG X, RONG M, et al. 1-D fluid model of atmospheric-pressure of He+O2cold plasmas: parametric study and critical evaluation[J]. Physics of Plasmas, 2011, 18(11): 113503. DOI:10.1063/1.3655441
-
[29]GONG X, TAKAGI S, HUANG H, et al. A numerical study of mass transfer of ozone dissolution in bubble plumes with an Euler-Lagrange method[J]. Chemical Engineering Science, 2007, 62(4): 1081-1093.
-
[30]PASTINA B, LAVERNE J A. Effect of molecular hydrogen on hydrogen peroxide in water radiolysis[J]. The Journal of Physical Chemistry A, 2001, 105(40): 9316-9322.
-
[31]BARAT F, GILLES L, HICKEL B, et al. Flash photolysis of chlorate ion in aqueous solution[J]. The Journal of Physical Chemistry, 1971, 75(14): 2177-2181.
-
[32]SCHWEITZER C, SCHMIDT R. Physical mechanisms of generation and deactivation of singlet oxygen[J]. Chemical Reviews, 2003, 103(5): 1685-1758.
-
[33]HEIKES B G. Aqueous H2O2 production from O3 in glass impingers[J]. Atmospheric Environment, 1984, 18(7): 1433-1445.
-
[34]CENTS A H G, BRILMAN D W F, VERSTEEG G F. Ultrasonic investigation of hydrodynamics and mass transfer in a Gas-Liquid(-Liquid) Stirred Vessel[J]. International Journal of Chemical Reactor Engineering, 2005, 3(1): 1542-1550.